गैलियम
गैलिअम एक रासायनिक तत्व है। यह प्रकृति में शुद्ध रूप में नहीं मिलता लेकिन इसके यौगिक बॉक्साइट और जस्ते के खनिजों में अल्प-मात्रा में पाये जाते हैं। अपने शुद्ध रूप में यह एक मुलायम और चमकीली धातु है जिसका पिघलाव तापमान केवल २९.७६ °सेंटिग्रेड है, यानि यह अक्सर साधारण तापमान में पिघल जाता है। इसकी खोज सन् १८७५ में हुई थी और तब से इसका प्रयोग ऐसी मिश्र धातुओं को बनाने के लिये किया जाता है जो कम तापमान पर पिघल जाएँ। इसका इस्तेमाल अर्धचालकों (सेमिकन्डक्टरों) में भी होता है।[1][2]
| गैलियम / Gallium रासायनिक तत्व | |
 | |
| रासायनिक चिन्ह: | Ga |
| परमाणु संख्या: | 31 |
| रासायनिक शृंखला: | संक्रमणोपरांत धातु |
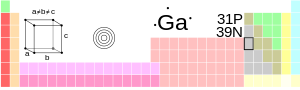 आवर्त सारणी में स्थिति
| |
 | |
| अन्य भाषाओं में नाम: | Gallium (अंग्रेज़ी) |
चित्र
संपादित करें-
गैलिअम के क्रिस्टल
-
गैलिअम की बूँद
-
गैलिअम का टुकड़ा
इन्हें भी देखें
संपादित करेंभौतिक गुण पिघल से गैलियम के क्रिस्टलीकरण
मौलिक गैलियम प्रकृति में नहीं पाया जाता है, लेकिन यह आसानी से गलाने से प्राप्त की है। बहुत शुद्ध गैलियम धातु एक चांदी के रंग और इसके ठोस धातु भंग conchoidally शीशे की तरह है। गैलियम तरल जब यह solidifies 3.1% से फैलता है; इसलिए, यह गिलास या धातु के कंटेनर में संग्रहित नहीं किया जाना चाहिए क्योंकि कंटेनर जब गैलियम राज्य में परिवर्तन बिगाड़ सकता। गैलियम अन्य सामग्री की एक छोटी सूची है कि पानी, सिलिकॉन, जर्मेनियम, सुरमा, विस्मुट, और प्लूटोनियम शामिल है के साथ उच्च-घनत्व तरल अवस्था के शेयरों। [4]
गैलियम हमलों धातु जाली में diffusing से अधिकांश अन्य धातुओं। उदाहरण के लिए, यह एल्यूमीनियम, जस्ता मिश्र [5] और इस्पात, [6] उन्हें बहुत भंगुर बनाने का अनाज की सीमाओं में diffuses। गैलियम आसानी से कई धातुओं के साथ मिश्र धातु, और प्लूटोनियम क्रिस्टल संरचना को स्थिर करने के लिए परमाणु बम की प्लूटोनियम कोर में प्लूटोनियम गैलियम मिश्र धातु में कम मात्रा में प्रयोग किया जाता है। [7]
गैलियम का गलनांक, 302.9146 कश्मीर (29.7646 डिग्री सेल्सियस, 85.5763 ° एफ) में, बस कमरे के तापमान से ऊपर है, और लगभग पृथ्वी के मध्य अक्षांश में औसत गर्मियों में दिन का तापमान के रूप में ही है। इस गलनांक (मध्य प्रदेश) 1990 (आईटीएस-90) बाट और माप के अंतर्राष्ट्रीय ब्यूरो (BIPM) द्वारा स्थापित की अंतर्राष्ट्रीय तापमान पैमाने में औपचारिक तापमान संदर्भ बिंदुओं में से एक है। [8] [9] [10] गैलियम की ट्रिपल बिंदु, 302.9166 कश्मीर (29.7666 डिग्री सेल्सियस, 85.5799 °F), गलनांक को वरीयता में मानकों का अमेरिका के राष्ट्रीय संस्थान और प्रौद्योगिकी (NIST) द्वारा किया जाता है। [11]
गैलियम की अनूठी गलनांक यह मनुष्य के हाथ में पिघल, और उसके बाद अगर हटा दिया refreeze अनुमति देता है। तरल धातु एक मजबूत अपनी गलनांक / हिमांक से नीचे सर्द करने की प्रवृत्ति है। एक क्रिस्टल के साथ सीडिंग ठंड आरंभ करने के लिए मदद करता है। गैलियम चार धातुओं के साथ (सीज़ियम, रूबिडीयाम, और पारा) उस पर तरल, या पास, सामान्य कमरे के तापमान हो जाना जाता है में से एक है। चार में से केवल एक गैलियम है कि न तो उच्च प्रतिक्रियाशील है और न ही बेहद जहरीला है और इसलिए धातु में ग्लास उच्च तापमान थर्मामीटर में इस्तेमाल किया जा सकता है। यह भी एक धातु के लिए सबसे बड़ा तरल श्रृंखलाओं में से एक होने के लिए और (पारा) के विपरीत होने के उच्च तापमान पर एक कम वाष्प दबाव के लिए उल्लेखनीय है। गैलियम का क्वथनांक, 2673 कश्मीर, पूर्ण पैमाने पर, गलनांक और किसी भी तत्व का क्वथनांक के बीच सबसे बड़ा अनुपात पर इसके पिघलने बिंदु से भी अधिक की तुलना में आठ गुना अधिक है। [12] पारा, तरल गैलियम धातु wets कांच और त्वचा, सबसे अन्य सामग्री के साथ-साथ (क्वार्ट्ज, ग्रेफाइट, और Teflon के अपवाद के साथ), यह यंत्रवत् अधिक मुश्किल को संभालने के लिए भले ही यह काफी कम विषैला होता है और बनाने के विपरीत अब तक कम सावधानियों की आवश्यकता है। कांच पर चित्रित गैलियम एक शानदार दर्पण है। [13] इस कारण के रूप में अच्छी तरह के रूप में धातु संदूषण और ठंड विस्तार समस्याओं के लिए, गैलियम धातु के नमूने आमतौर पर अन्य कंटेनरों के भीतर पॉलीथीन पैकेट में आपूर्ति की जाती है। अलग क्रिस्टल कुल्हाड़ियों [14] गुण एक बी सी के लिए गैलियम के गुण α (~ 25 डिग्री सेल्सियस, माइक्रोन / मी) 16 11 31 ρ (29.7 डिग्री सेल्सियस, nΩ · मी) 543 174 81 ρ (0 डिग्री सेल्सियस, nΩ · मी) 480 154 71.6 ρ (77 कश्मीर, nΩ · मी) 101 30.8 14.3 ρ (4.2 कश्मीर, pΩ · मी) 13.8 6.8 1.6
गैलियम सरल क्रिस्टल संरचनाओं में से किसी में मणिभ नहीं है। सामान्य परिस्थितियों में स्थिर चरण पारंपरिक इकाई कक्ष में 8 परमाणुओं के साथ orthorhombic है। एक इकाई कोशिका के भीतर, प्रत्येक परमाणु (244 बजे की दूरी पर) केवल एक निकटतम पड़ोसी है। शेष छह यूनिट सेल पड़ोसियों 27 स्थान दिया गया है, 30 और 39 बजे दूर दूर, और वे एक ही दूरी के साथ जोड़े में बांटा जाता है। [15] कई स्थिर और metastable चरणों तापमान और दबाव के समारोह के रूप में पाए जाते हैं। [16]
दो निकटतम पड़ोसी देशों के बीच संबंधों के सहसंयोजक है; इसलिए GA2 dimers क्रिस्टल के मौलिक ब्लॉकों इमारत के रूप में देखा जाता है। यह कम गलनांक पड़ोसी तत्वों, एल्यूमीनियम और ईण्डीयुम के सापेक्ष बताते हैं। इस संरचना ऊँची आयोडीन और क्योंकि गैलियम परमाणुओं के एकल 4P इलेक्ट्रॉनों के बीच बातचीत के रूपों के समान है, आगे 4S इलेक्ट्रॉनों और [ar] 3d10 कोर की तुलना में नाभिक से दूर है। यह घटना अपने 'छद्म नोबल गैस "[Xe] 4f145d106s2 इलेक्ट्रॉन विन्यास, जो कमरे के तापमान पर तरल है साथ पारा के साथ बारंबार। [17] 3d10 इलेक्ट्रॉनों नाभिक से बहुत अच्छी तरह से बाहरी इलेक्ट्रॉनों को ढाल नहीं है और इसलिए गैलियम की पहली आयनीकरण ऊर्जा एल्यूमीनियम की तुलना में अधिक है। [4]
गैलियम के भौतिक गुणों अत्यधिक anisotropic कर रहे हैं, साथ में तीन प्रमुख crystallographical कुल्हाड़ियों ए, बी, और सी (तालिका देखें), रैखिक (α) और मात्रा थर्मल विस्तार गुणांक के बीच एक महत्वपूर्ण अंतर का निर्माण अर्थात अलग मूल्य नहीं है। गैलियम के गुणों को विशेष रूप से पिघलने बिंदु के पास, दृढ़ता से तापमान पर निर्भर कर रहे हैं। उदाहरण के लिए, थर्मल विस्तार के गुणांक पिघलने पर कई सौ प्रतिशत तक बढ़ जाती है। [14] रासायनिक गुण यह भी देखें: श्रेणी: गैलियम यौगिकों।
गैलियम मुख्य रूप से 3 ऑक्सीकरण राज्य में पाया जाता है। +1 ऑक्सीकरण भी कुछ यौगिकों में पाया जाता है। उदाहरण के लिए, बहुत स्थिर GaCl2 दोनों गैलियम (आई) और गैलियम (तृतीय) में शामिल है और GaIGaIIICl4 के रूप में तैयार किया जा सकता है; इसके विपरीत, monochloride 0 डिग्री सेल्सियस मौलिक गैलियम और गैलियम (तृतीय) क्लोराइड में disproportionating ऊपर अस्थिर है। गैलियम गैलियम बांड युक्त यौगिकों सच गैलियम (द्वितीय) यौगिकों हैं; उदाहरण के लिए, गैस तैयार की जा सकती है Ga24 + (S2-) 2, और dioxan जटिल Ga2Cl4 (C4H8O2) 2 एक गा-गा बंधन होता है। [18] Chalcogen यौगिकों
गैलियम केवल अपेक्षाकृत उच्च तापमान पर chalcogens साथ प्रतिक्रिया करता है। कमरे के तापमान पर, गैलियम धातु, क्योंकि यह एक निष्क्रिय, सुरक्षात्मक ऑक्साइड परत रूपों हवा और पानी के साथ प्रतिक्रियाशील नहीं है। उच्च तापमान पर, तथापि, यह वायुमंडलीय ऑक्सीजन के साथ प्रतिक्रिया करता गैलियम के लिए फार्म (तृतीय) ऑक्साइड, गा 2O 3. [19] गा कम करना 2O 700 डिग्री सेल्सियस के लिए 500 डिग्री सेल्सियस पर निर्वात में मौलिक गैलियम के साथ 3, पैदावार गहरे भूरे रंग गैलियम (आई) ऑक्साइड गा । 2O [20]: 285 गा 2O, एक बहुत मजबूत कम करने एजेंट है एच को कम करने के लिए सक्षम 2SO 4 ज । 2S [20]: 207 यह 800 डिग्री सेल्सियस पर वापस गैलियम और गा करने disproportionates 2O 3. [21]
गैलियम (तृतीय) सल्फाइड, गा 2S 3, 3 संभव क्रिस्टल संशोधनों है [21]:। 104 यह हाइड्रोजन सल्फाइड के साथ गैलियम की प्रतिक्रिया से बनाया जा सकता है (एच 2S) 950 डिग्री सेल्सियस पर [20]:। 162 वैकल्पिक रूप से, गा (OH) 3 747 डिग्री सेल्सियस पर इस्तेमाल किया जा सकता है: [22]
2 गा (OH) 3 + 3 एच 2S → गा 2S 3 + 6 एच 2O
क्षार धातु कार्बोनेट और गा का एक मिश्रण प्रतिक्रिया 2O एच के साथ 3 2S युक्त [ga thiogallates के गठन की ओर जाता है 2S 4] 2- आयनों। मजबूत एसिड इन लवण घुलना, एच रिहा इस प्रक्रिया में 2S [21]:। 104-105 पारा नमक, HgGa 2S 4, एक भास्वर रूप में इस्तेमाल किया जा सकता है। [23]
गैलियम भी गैलियम (द्वितीय) सल्फाइड और हरे रंग गैलियम (मैं) सल्फाइड, जो बाद के नाइट्रोजन की एक धारा के तहत 1000 डिग्री सेल्सियस तक गर्म करने से पूर्व से निर्मित है के रूप में कम ऑक्सीकरण राज्यों में sulfides रूपों [21]।: 94
अन्य द्विआधारी chalcogenides, गा 2SE 3 और गा 2Te 3, zincblende संरचना है। वे सभी अर्धचालकों हैं, लेकिन आसानी से HYDROLYSED कर रहे हैं और सीमित उपयोगिता है [21]:। 104 जलीय रसायन विज्ञान
मजबूत एसिड गैलियम भंग, इस तरह के रूप में गा गैलियम (तृतीय) लवण गठन 2 (एसओ 4) 3 (गैलियम सल्फेट) और गा (सं 3) 3 (गैलियम नाइट्रेट)। गैलियम के जलीय समाधान (तृतीय) लवण हाइड्रेटेड गैलियम आयन, [गा (एच शामिल 2O) 6] 3 + । [24]: 1033 गैलियम (तृतीय) हाइड्रोक्साइड, गा (OH) 3, गैलियम (तृतीय) अमोनिया जोड़कर समाधान से उपजी जा सकता है। Dehydrating गा (OH) 100 डिग्री सेल्सियस पर 3 गैलियम ऑक्साइड हाइड्रॉक्साइड, गाओ (OH) का उत्पादन [20]:। 140-141
क्षारीय हाइड्रॉक्साइड समाधान गैलियम भंग, गा (ओएच) युक्त gallate लवण गठन - । 4 आयनों [19] [24]:। 1033 [25] गैलियम हाइड्रोक्साइड, जो उभयधर्मी है, भी gallate लवण के लिए फार्म क्षार [20] घुल: 141 हालांकि पहले काम का सुझाव दिया गा (OH) 3 6 एक और संभव gallate आयनों, [26] यह नहीं बाद में काम में पाया गया था। [25] Pnictogen यौगिकों गैलियम नाइट्राइड (बाएं) और गैलियम आर्सेनाइड (दाएं) क्रिस्टल
गैलियम, गैलियम नाइट्राइड के लिए फार्म गण मन 1,050 डिग्री सेल्सियस पर अमोनिया के साथ प्रतिक्रिया करते हैं। गैलियम फास्फाइड (जीएपी), गैलियम आर्सेनाइड (GaAs), और गैलियम antimonide (gasb): गैलियम भी फास्फोरस, आर्सेनिक, और सुरमा के साथ बाइनरी यौगिकों रूपों। इन यौगिकों ZnS के रूप में एक ही संरचना है, और महत्वपूर्ण semiconducting गुण होते हैं [24]:। 1034 गैप, GaAs, और gasb मौलिक फास्फोरस, आर्सेनिक, या सुरमा के साथ गैलियम की सीधी प्रतिक्रिया से संश्लेषित किया जा सकता है [21]। वे 99 गण मन की तुलना में अधिक विद्युत चालकता दिखा रहे हैं [21]:। 101 खाई भी गा प्रतिक्रिया द्वारा संश्लेषित किया जा सकता कम तापमान पर फास्फोरस के साथ 2O। [27]
गैलियम त्रिगुट nitrides रूपों; उदाहरण के लिए: [21]: 99
ली 3Ga + N 2 → ली 3GaN 2
फास्फोरस और आर्सेनिक के साथ इसी तरह के यौगिकों संभव हो रहे हैं: ली 3GaP 2 और ली 3GaAs 2. इन यौगिकों आसानी से पतला एसिड और पानी से hydrolyzed कर रहे हैं [21]:। 101 halides इन्हें भी देखें: गैलियम halides
गैलियम (तृतीय) ऑक्साइड ऐसी एचएफ या एफ के रूप में fluorinating एजेंटों के साथ प्रतिक्रिया करता है 2 गैलियम (तृतीय) फ्लोराइड फार्म, GAF 3. यह एक आयनिक यौगिक पानी में जोरदार अघुलनशील है। हालांकि, यह Hydrofluoric एसिड में घुल, जिसमें यह पानी, GAF के साथ एक अभिवर्तन रूपों 3 · 3H 2O। इस अभिवर्तन निर्जलीकरण करने का प्रयास रूपों GAF 2OH · राष्ट्रीय राजमार्ग 2O। अभिवर्तन अमोनिया GAF के लिए फार्म के साथ प्रतिक्रिया 3 · 3NH 3, जो तब निर्जल GAF के लिए फार्म गर्म किया जा सकता 3. [20]: 128-129
गैलियम trichloride क्लोरीन गैस के साथ गैलियम धातु की प्रतिक्रिया से गठन किया गया है। [19] trifluoride के विपरीत, गैलियम (तृतीय) क्लोराइड, dimeric अणुओं के रूप में मौजूद है गा 2Cl 6, 78 डिग्री सेल्सियस के पिघलने बिंदु के साथ। Eqivalent यौगिकों ब्रोमीन और आयोडीन, गा के साथ बनते हैं 2BR 6 और गा 2I 6. [20]: 133
दूसरे समूह के 13 trihalides, गैलियम की तरह (तृतीय) halides के रूप में halide क्षार धातु halides GaX- युक्त लवण के लिए फार्म के साथ स्वीकार प्रतिक्रिया लुईस एसिड होते हैं, 4 anions, जहां एक्स एक हैलोजन है। उन्होंने यह भी carbocations और GaX- के लिए फार्म alkyl halides के साथ प्रतिक्रिया 4. [20]: 136-137
जब एक उच्च तापमान पर गरम, गैलियम (तृतीय) halides मौलिक गैलियम संबंधित गैलियम (आई) halides के लिए फार्म के साथ प्रतिक्रिया। उदाहरण के लिए, जीएसीएल गा के साथ 3 प्रति प्रतिक्रिया जीएसीएल के लिए फार्म:
2 गा + जीएसीएल 3 ⇌ 3 जीएसीएल (G)
कम तापमान पर, संतुलन बाईं ओर बदलाव और जीएसीएल मौलिक गैलियम और जीएसीएल के लिए वापस disproportionates 3. जीएसीएल भी 950 डिग्री सेल्सियस पर एचसीएल के साथ गा प्रतिक्रिया द्वारा उत्पादित किया जा सकता है; उत्पाद के रूप में एक लाल ठोस सघन जा सकता है [24]:। 1036
गैलियम (आई) यौगिकों लुईस एसिड के साथ adducts के गठन से स्थिर किया जा सकता है। उदाहरण के लिए:
जीएसीएल + AlCl 3 → गा + [AlCl 4] -
तथाकथित "गैलियम (द्वितीय) halides", GaX 2, वास्तव में गैलियम की adducts (आई) संबंधित गैलियम (तृतीय) halides साथ halides, संरचना गा कर रहे हैं + [GaX 4] - । उदाहरण के लिए: [19] [24]: 1036 [28]
जीएसीएल + जीएसीएल 3 → गा + [जीएसीएल 4] -
हाइड्रोजन यौगिकों
एल्यूमीनियम की तरह, गैलियम भी एक हाइड्राइड रूपों, गाह 3, gallane के रूप में जाना जाता है, जो लिथियम gallanate प्रतिक्रिया द्वारा उत्पादित किया जा सकता है (LiGaH 4) गैलियम के साथ (तृतीय) -30 डिग्री सेल्सियस पर क्लोराइड: [24]: 1031
3 LiGaH 4 + जीएसीएल 3 → 3 LiCl 4 गाह 3
विलायक, गाह के रूप में डाइमिथाइल ईथर की उपस्थिति में 3 (गाह को polymerizes 3) एन। कोई विलायक प्रयोग किया जाता है, तो डिमर गा 2H 6 (digallane) एक गैस के रूप में गठन किया गया है। इसकी संरचना diborane के समान है, होने दो हाइड्रोजन परमाणुओं दो गैलियम केन्द्रों ब्रिजिंग, [24]: 1031 α-एएलएच के विपरीत 3, जिसमें एल्यूमीनियम का 6. [24] एक समन्वय संख्या है: 1008
Gallane मौलिक गैलियम और हाइड्रोजन को decomposing -10 डिग्री सेल्सियस से ऊपर अस्थिर है। [29] इतिहास फ़ाइल: गैलियम drops.ogvPlay मीडिया छोटे गैलियम बूंदों को एक साथ fusing।
1871 में, गैलियम का अस्तित्व पहले रूसी रसायनज्ञ मेंडलीफ, जो इसे अपने आवर्त सारणी में अपनी स्थिति से "एका-एल्यूमीनियम" नाम से भविष्यवाणी की थी। उन्होंने यह भी एका-एल्यूमीनियम के कई गुण है कि इस तरह के अपने घनत्व, गलनांक, ऑक्साइड चरित्र और संबंध क्लोराइड के रूप में गैलियम का असली गुण, को बारीकी अनुरूप भविष्यवाणी की। [30] Mendeleev के 1871 भविष्यवाणियों और गैलियम के ज्ञात गुण [31] गुण Mendeleev भविष्यवाणियों वास्तविक गुणों के बीच तुलना परमाणु वजन ~ 68 69.723 घनत्व 5.9 ग्राम / सेमी 3 5.904 ग्राम / सेमी 3 गलनांक कम 29.767 डिग्री सेल्सियस ऑक्साइड M2O3 Ga2O3 का फॉर्मूला ऑक्साइड 5.5 ग्राम / सेमी 3 5.88 g / cm3 का घनत्व हाइड्रॉक्साइड उभयधर्मी उभयधर्मी की प्रकृति
Mendeleev आगे भविष्यवाणी की है कि एका-एल्यूमीनियम स्पेक्ट्रोस्कोप के माध्यम से पता चला जाएगा, और है कि धातु एका-एल्यूमीनियम दोनों अम्ल और क्षार में धीरे धीरे भंग होता है और हवा के साथ प्रतिक्रिया नहीं होता। उन्होंने यह भी भविष्यवाणी की है कि M2O3 एसिड में भंग होगा MX3 लवण देने के लिए, कि एका-एल्यूमीनियम लवण बुनियादी लवण के रूप में होगा, कि एका-एल्यूमीनियम सल्फेट alums फार्म चाहिए, और है कि निर्जल MCl3 ZnCl2 की तुलना में अधिक उतार-चढ़ाव होना चाहिए: इन भविष्यवाणियों कर दिया की सभी बाहर सच हो सकता है। [31]
गैलियम sphalerite के एक नमूने में इसकी विशेषता स्पेक्ट्रम से 1875 में फ्रांसीसी रसायनज्ञ पॉल एमिल Lecoq डी Boisbaudran द्वारा स्पेक्ट्रोस्कोपी का उपयोग (दो बैंगनी लाइनों) की खोज की थी। [32] बाद में उस वर्ष, Lecoq पोटेशियम हाइड्रॉक्साइड समाधान में हाइड्रॉक्साइड के इलेक्ट्रोलिसिस से मुक्त धातु प्राप्त की। वह तत्व "Gallia", लैटिन Gallia से गॉल अर्थ का नाम है, फ्रांस के अपने पैतृक भूमि के बाद। बाद में यह दावा किया गया था कि, उन बहुभाषी puns इसलिए 19 वीं सदी में विज्ञान के पुरुषों द्वारा प्रेमिका से एक में, वह भी गैलियम खुद के नाम पर रखा था, 'Le Coq "के लिए" मुर्गा "और" मुर्गा "के लिए लैटिन शब्द फ्रेंच है "Gallus" है। एक 1877 लेख में, Lecoq इस अनुमान से इनकार किया है। [33] मूल रूप से, डी Boisbaudran 4.7 के रूप में गैलियम का घनत्व निर्धारित की ग्राम / सेमी 3, केवल संपत्ति है कि Mendeleev की भविष्यवाणियों से मिलान करने में विफल रहा है; Mendeleev तो उसे करने के लिए लिखा था और सुझाव दिया है कि वह घनत्व remeasure चाहिए, और डी Boisbaudran तो 5.9 का सही मूल्य प्राप्त g / cm3, कि Mendeleev लगभग ठीक भविष्यवाणी की थी। [31]
1875 में इसकी खोज के अर्धचालकों के युग तक, गैलियम का प्राथमिक उपयोग उच्च तापमान Thermometrics और स्थिरता या पिघलने की आसानी के असामान्य गुण (कमरे के तापमान पर कुछ इस तरह से किया जा रहा तरल) के साथ धातु मिश्र थे। 1960 के दशक के गैलियम के अनुप्रयोगों में सबसे महत्वपूर्ण चरण की शुरुआत में एक प्रत्यक्ष बैंड अंतराल अर्धचालक के रूप में गैलियम आर्सेनाइड के विकास। [13]
सन्दर्भ
संपादित करें- ↑ Vigilante, G. N.; Trolano, E.; Mossey, C. (June 1999). "Liquid Metal Embrittlement of ASTM A723 Gun Steel by Indium and Gallium". Defense Technical Information Center. Retrieved 2009-07-07.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 240. ISBN 0080379419.