सोडियम बाईकार्बोनेट
सोडियम बाईकार्बोनेट एक कार्बनिक यौगिक है। इसे मीठा सोडा या 'खाने का सोडा' (बेकिंग सोडा) भी कहते हैं क्योंकि विभिन्न व्यंजनों को बनाने में इसका उपयोग किया जाता है। इसका अणुसूत्र NaHCO3 है। इसका आईयूपीएसी नाम 'सोडियम हाइड्रोजन कार्बोनेट' है। सोडियम बाय कार्बोनेट भी कहते है।
| सोडियम बाईकार्बोनेट | |
|---|---|
| |
 |
 |

| |
| आईयूपीएसी नाम | सोडियम हाइड्रोजन कार्बोनेट |
| अन्य नाम | खाने का सोडा (Baking soda), bicarb (laboratory slang), bicarbonate of soda, nahcolite |
| पहचान आइडेन्टिफायर्स | |
| सी.ए.एस संख्या | [144-55-8][CAS] |
| पबकैम | |
| EC संख्या | |
| ड्रग बैंक | DB01390 |
| केईजीजी | C12603 |
| MeSH | Sodium+bicarbonate |
| रासा.ई.बी.आई | 32139 |
| RTECS number | VZ0950000 |
| SMILES | |
| InChI | |
| 4153970 | |
| कैमस्पाइडर आई.डी | |
| गुण | |
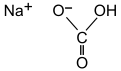
| आण्विक सूत्र | NaHCO3 |
| मोलर द्रव्यमान | 84.0066 g mol−1 |
| दिखावट | White crystals |
| गंध | Odorless |
| घनत्व |
|
| जल में घुलनशीलता | |
| घुलनशीलता | 0.02 wt% acetone, 2.13 wt% methanol @22 °C.[4] insoluble in ethanol |
| log P | −0.82 |
| अम्लता (pKa) | |
| रिफ्रेक्टिव इंडेक्स (nD) | nα = 1.377 nβ = 1.501 nγ = 1.583 |
| ढांचा | |
| Crystal structure | Monoclinic |
| Thermochemistry | |
| फॉर्मेशन की मानक एन्थाल्पीΔfH |
−950.8 kJ/mol[6] |
| मानक मोलीय एन्ट्रॉपी S |
101.7 J/mol K[6] |
| Pharmacology | |
| खतरा | |
| Main hazards | Causes serious eye irritation |
| NFPA 704 | |
| स्फुरांक (फ्लैश पॉइन्ट) | Incombustible |
| एलडी५० | 4220 mg/kg (rat, oral)[7] |
| Related compounds | |
| Other आयन | Sodium carbonate |
| Other cations | |
| जहां दिया है वहां के अलावा, ये आंकड़े पदार्थ की मानक स्थिति (२५ °से, १०० कि.पा के अनुसार हैं। ज्ञानसन्दूक के संदर्भ | |
सोडियम बाई कार्बोनेट (NaHCO3) का उपयोग प्रतिअम्लों (अम्लीयता कम करने) के रूप मे, सोडायुक्त पेय पदार्थ के रूप मे, अग्निशामक के रूप मे किया जाता है।
सोडियम बाई कार्बोनेट (NaHCO3) आसानी से कार्बन डाई आक्साइड उत्पन्न कर सकता है व कार्बन डाई आक्साइड गैस हवा से भारी होनेे के कारण आग तथा वायु के मध्य एक परत का निर्माण कर लेती है, जिससे आग का वायु से संपर्क टूट जाता है व आग बुझ जाती है।
सोडियम बाई कार्बोनेट (NaHCO3) आसानी से कार्बन डाई आक्साइड उत्पन्न कर सकता है व कार्बन डाई आक्साइड गैस हवा से भारी होनेे के कारण आग तथा वायु के मध्य एक परत का निर्माण कर लेती है, जिससे आग का वायु से संपर्क टूट जाता है व आग बुझ जाती है।
टिप्पणी : यदि प्रयोगशाला(Laboratory) आदि मे क्षार(Base) के कारण आग लगी हो वहाँ पर NaHCO3 का प्रयोग नही कर सकते है अन्यथा आग और प्रचण्ड(भीषण) रूप ले सकती है। वहाँँ हम अग्निशामक के रूप मे पायरीन (CCl4) का प्रयोग करते है।[8]
सन्दर्भ
संपादित करें- ↑ Haynes, p. 4.90
- ↑ अ आ इ Haynes, p. 5.194
- ↑ अ आ इ "Sodium Bicarbonate" (PDF). United Nations Environment Programme. मूल (PDF) से 2011-05-16 को पुरालेखित.
- ↑ Ellingboe JL, Runnels JH (1966). "Solubilities of Sodium Carbonate and Sodium Bicarbonate in Acetone-Water and Methanol-Water Mixtures". J. Chem. Eng. Data. 11 (3): 323–324. डीओआइ:10.1021/je60030a009.
- ↑ अ आ Haynes, p. 7.23
- ↑ अ आ इ Haynes, p. 5.19
- ↑ Chambers M. "Sodium bicarbonate [USP:JAN]". ChemIDplus. U.S. National Library of Medicine. मूल से 20 दिसंबर 2019 को पुरालेखित. अभिगमन तिथि 10 जून 2020.
- ↑ rupesh, singh. "सोडियम बाईकार्बोनेट". teb hindi. मूल से 6 जून 2020 को पुरालेखित. अभिगमन तिथि 10 जून 2020.
इन्हें भी देखें
संपादित करें- सोडियम कार्बोनेट (धावन सोडा)
बाहरी कड़ियाँ
संपादित करें- मीठे सोडे के 61 उपयोग (अंग्रेजी में)
