खण्ड (आवर्त सारणी)
आवर्ती खण्ड आवर्त सारणी में रासायनिक तत्त्वों के कुछ वर्गों को कहते हैं। इस शब्द को प्रथम बार फ़्रांसीसी में शार्ल जानै ने प्रयोग किया था।[1] आवर्त सारणी के ऊर्ध्वाधर स्तम्भों में स्थित तत्त्व एक वर्ग अथवा परिवार की रचना करते हैं, और समान रासायनिक गुणधर्म दर्शाते हैं। यह समानता इसलिए होती है, क्योंकि इन तत्त्वों के बाह्यतम इलेक्ट्रॉन कोश में इलेक्ट्रॉनों की संख्या और वितरण एक ही प्रकार का होता है।[2] अतः इन तत्त्वों का विभाजन निमोक्त विभिन्न खण्डों किया जा सकता है, जो इलेक्ट्रॉनों द्वारा भरे जा रहे कक्षकों के प्रकार पर निर्भर करता है:
- s-खण्ड
- p-खण्ड
- d-खण्ड
- f-खण्ड
- g-खण्ड
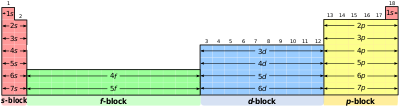
वैद्युतिक विन्यास तथा तत्त्वों के प्रकार
संपादित करेंउपरोक्त प्रकार के वर्गीकरण में दो अपवाद देखने को मिलते हैं। प्रथम अपवाद है कि हीलियम को s-खण्ड के तत्त्वों में सम्बद्ध होना चाहिए परन्तु इसका स्थान आवर्त सारणी में वर्ग 18 के तत्त्वों के साथ 12 खण्ड में है। इसका औचित्य इस आधार पर है कि हीलियम का संयोजक कोश पूरा भरा हुआ है (He=1s²) जिसके फलस्वरूप यह उत्कृष्ट तत्त्व के अभिलक्षणों को प्रदर्शित करती है। द्वितीय अपवाद है कि हाइड्रोजन में केवल एक s इलेक्ट्रॉन है। (H=1s¹) इस प्रकार इसका स्थान वर्ग 1 में क्षारीय धातुओं के साथ होना चाहिए। दूसरी ओर, यह एक इलेक्ट्रॉन ग्रहण करके उत्कृष्ट तत्त्व (हीलियम) का वैद्युतिक विन्यास प्राप्त कर सकती है। इस प्रकार इसका व्यवहार वर्ग 17 (हैलोजन) की भाँति हो सकता है। चूँकि यह एक विशेष स्थिति है, अतः हाइड्रोजन को आवर्त सारणी में सबसे ऊपर अलग से स्थान देना अधिक तर्कसंगत माना गया है।
s-खण्ड तत्त्व
संपादित करेंवर्ग 1 के तत्त्वों (क्षारीय धातुओं) तथा वर्ग 2 के तत्त्वों (क्षारीय पार्थिव धातुओं) के बाह्यतम कोश के सामान्य वैद्युतिक विन्यास क्रमश: ns¹ तथा ns² हैं। इन दोनों वर्गों के तत्त्व आवर्त सारणी के s-खण्ड से सम्बद्ध हैं। ये सभी क्रियाशील धातुएँ हैं। इनके आयनन ऊर्जा के मान कम होते हैं। ये तत्त्व सरलतापूर्वक बाह्यतम इलेक्ट्रॉन त्यागने के पश्चात् 1+ आयन (क्षारीय धातुओं में) या 2+ आयन (क्षारीय पार्थिव धातुओं में) बना लेते हैं। वर्ग में नीचे की ओर जाने पर इन धातुओं के धात्विक लक्षण तथा अभिक्रियाशीलता में वृद्धि होती है। अधिक अभिक्रियाशील होने के कारण वे प्रकृति में शुद्ध रूप में नहीं पाई जाती है। लीथियम और बेरीलियम के अतिरिक्त इस खण्ड के तत्त्वों के यौगिक मुख्य रूप से आयनीय होते हैं।
p-खण्ड तत्त्व
संपादित करेंआवर्त सारणी के p-खण्ड में वर्ग 13 से लेकर वर्ग 18 तक के तत्त्व सम्मिलित हैं। p-खण्ड के तत्त्वों और s-खण्ड के तत्त्वों को संयुक्त रूप से मुख्य-वर्ग तत्त्व कहा जाता है। प्रत्येक आवर्त में इनका सामान्य वैद्युतिक विन्यास ns² np1—6 होता है। प्रत्येक आवर्त में उत्कृष्ट तत्त्व, ns² np⁶ वैद्युतिक विन्यास के साथ समाप्त होते हैं। उत्कृष्ट तत्त्वों में संयोजी कोश में सभी कक्षक इलेक्ट्रॉनों से पूर्ण भरे होते हैं। इलेक्ट्रॉनों को हटाकर या जोड़कर इस स्थायी व्यवस्था को बदलना बहुत कठिन होता है। इसीलिए उत्कृष्ट तत्त्वों की रासायनिक अभिक्रियाशीलता बहुत कम होती हैं। उत्कृष्ट तत्त्वों के परिवार से पूर्व अधातुओं के रासायनिक रूप से दो महत्त्वपूर्ण वर्ग हैं। ये वर्ग हैं 17वें वर्ग के हैलोजन तथा 16वें वर्ग के तत्त्व 'खाल्कोजन'। इन दो वर्गों के तत्त्वों की उच्च ऋणात्मक इलेक्ट्रॉन बन्धुता होती है। ये तत्त्व सहजता से क्रमश: एक या दो इलेक्ट्रॉन ग्रहण कर स्थायी उत्कृष्ट वैद्युतिक विन्यास प्राप्त कर लेते हैं। आवर्त में बाईं से दाईं ओर बढ़ने पर तत्त्वों के अधात्विक लक्षणों में वृद्धि होती है तथा किसी वर्ग में ऊपर से नीचे की ओर जाने पर धात्विक लक्षणों में वृद्धि होती है।
d-खण्ड तत्त्व
संपादित करेंआवर्त सारणी के मध्य में स्थित वर्ग 3 से वर्ग 12 वाले तत्त्व d-खण्ड के तत्त्व कहलाते हैं। इस खण्ड के तत्त्वों की पहचान इनके आन्तरिक कक्षकों में इलेक्ट्रॉनों के भर्ती के आधार पर की जाती हैं। इन तत्त्वों का सामान्य वैद्युतिक विन्यास (n-1)d1—10 ns0—2 है। ये सभी तत्त्व धातुएँ हैं। इन तत्त्वों के आयन प्रायः रंगीन होते हैं तथा परिवर्ती संयोजकता एवं अनुचुम्बकत्व प्रदर्शित करते हैं, और उत्प्रेरक के रूप में प्रयुक्त होते हैं। d-खण्ड के तत्त्व रासायनिक तौर पर अतिक्रियाशील s-खण्ड के तत्त्वों तथा कम क्रियाशील 13वें तथा 14वें वर्गों के तत्त्वों के मध्य एक प्रकार से सेतु का कार्य करते हैं। इसी कारण d-खण्ड के तत्त्वों को 'संक्रमण तत्त्व' भी कहते हैं।
f-खण्ड तत्त्व full form
संपादित करेंमुख्य आवर्त सारणी में नीचे जिन तत्वों को दो क्षैतिज पंक्तियों में रखा गया है, उन्हें लैन्थेनॉइड तथा ऐक्टिनॉइड कहते हैं। इन श्रेणियों के तत्त्वों की पहचान इनके सामान्य वैद्युतिक विन्यास (n-2)f1—14 (n-1)d0—1 ns² द्वारा की जाती है। इन तत्वों में अन्तिम इलेक्ट्रॉन f उपकोश में भरता है। इन श्रेणियों के तत्त्वों को आन्तरिक संक्रमण तत्त्व भी कहते हैं। ये सभी तत्त्व धातुएँ हैं। प्रत्येक श्रेणी में तत्त्वों के गुण लगभग समान हैं। प्रारम्भिक ऐक्टीनॉइड श्रेणी के तत्त्वों की अनेक सम्भावित ऑक्सीकरण अवस्थाओं के फलस्वरूप इन तत्त्वों का रासायनिकी इनके संगत लेन्थेनॉइड श्रेणी के तत्त्वों की तुलना में अत्यधिक जटिल होता है। ऐक्टनॉइड तत्त्व रेडियोधर्मी होते हैं। बहुत से ऐक्टनॉइड तत्त्वों को नाभिकीय अभिक्रियाओं द्वारा नैनोग्राम या उससे भी कम भाग में प्राप्त किया गया है। इन तत्त्वों के रासायनिकी का पूर्णतः अध्ययन नहीं हो पाया है। यूरैनियम के पश्चात् वाले तत्त्व 'परायूरेनियम तत्त्व' कहलाते हैं।
सन्दर्भ
संपादित करें- ↑ Charles Janet, La classification helicoidal des elements chimiques, Beauvais, 1928
- ↑ Griffiths, David (1995). Introduction to Quantum Mechanics. Prentice Hall. pp. 190–191. ISBN 0-13-124405-1.