जन्मजात हृदय रोग
एक जन्मजात हृदय दोष ( सीएचडी ), जिसे जन्मजात हृदय विसंगति या जन्मजात हृदय रोग भी कहा जाता है, जन्म के समय मौजूद हृदय की संरचना में एक समस्या है ।[10] लक्षण और लक्षण विशिष्ट प्रकार की समस्या पर निर्भर करते हैं।[11] लक्षण किसी से भी जीवन में खतरनाक नहीं हो सकते हैं।[12] वर्तमान में जब वे तेजी से सांस लेने, नीली त्वचा, खराब वजन बढ़ाने, और थके हुए महसूस कर सकते हैं। यह छाती का दर्द नहीं होता है। अधिकांश जन्मजात दिल की समस्याएं अन्य बीमारियों से नहीं होती हैं। हृदय दोषों के परिणामस्वरूप जटिलताओं में दिल की विफलता शामिल है ।
| Congenital heart defect | |
|---|---|
| अन्य नाम | Congenital heart anomaly, congenital heart disease |
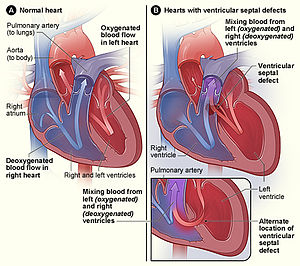 | |
| The normal structure of the heart (left) in comparison to two common locations for a ventricular septal defect (right), the most common form of congenital heart defect.[1] | |
| विशेषज्ञता क्षेत्र | Cardiology |
| लक्षण | Rapid breathing, bluish skin, poor weight gain, feeling tired[2] |
| जटिलता | Heart failure[2] |
| प्रकार | Cyanotic heart defects, non-cyanotic heart defects[3] |
| कारण | Often unknown[4] |
| संकट | Rubella infection during pregnancy, alcohol or tobacco, parents being closely related, poor nutritional status or obesity in the mother[3][5] |
| चिकित्सा | None, catheter based procedures, heart surgery, heart transplantation[3][6] |
| चिकित्सा अवधि | Generally good (with treatment)[7] |
| आवृत्ति | 48.9 million (2015)[8] |
| मृत्यु संख्या | 303,300 (2015)[9] |
जन्मजात हृदय दोष का कारण अक्सर अज्ञात होता है। कुछ मामलों में गर्भावस्था के दौरान संक्रमण हो सकता है जैसे रूबेला , कुछ दवाओं या शराब या तंबाकू जैसी दवाओं का उपयोग , माता-पिता निकटता से संबंधित हैं, या मां में खराब पोषण संबंधी स्थिति या मोटापे से ग्रस्त हैं ।[13] एक जन्मजात दिल दोष के साथ माता-पिता होने का जोखिम भी एक कारक है। डाउन सिंड्रोम , टर्नर सिंड्रोम , और मार्फन सिंड्रोम सहित कई आनुवांशिक स्थितियां हृदय दोषों से जुड़ी हैं । जन्मजात हृदय दोष दो मुख्य समूहों में विभाजित होते हैं: साइनोोटिक दिल दोष और गैर-साइनोोटिक हृदय दोष , इस पर निर्भर करता है कि बच्चे को रंग में नीली रंग बदलने की क्षमता है या नहीं। समस्याओं में हृदय की आंतरिक दीवारें, हृदय वाल्व , या बड़े रक्त वाहिकाओं को शामिल किया जा सकता है जो दिल से और उसके लिए जाते हैं।
जन्मजात हृदय दोष आंशिक रूप से रूबेला टीकाकरण , नमक के लिए आयोडीन जोड़ने और कुछ खाद्य उत्पादों को फोलिक एसिड जोड़ने के माध्यम से रोकथाम योग्य होते हैं । कुछ दोषों को इलाज की आवश्यकता नहीं है। दूसरों को कैथेटर आधारित प्रक्रियाओं या दिल की सर्जरी के साथ प्रभावी ढंग से इलाज किया जा सकता है ।[14] कभी-कभी कई परिचालनों की आवश्यकता हो सकती है, या हृदय प्रत्यारोपण की आवश्यकता हो सकती है। उचित उपचार के साथ, आम तौर पर जटिल समस्याएं भी होती हैं। हृदय दोष सबसे आम जन्म दोष हैं । 2015 में वे विश्व स्तर पर 48.9 मिलियन लोगों में मौजूद थे। वे निदान के तरीके के आधार पर प्रति 1000 जीवित जन्मों के बीच 4 से 75 के बीच प्रभावित होते हैं। प्रति 1,000 से 6 से 1 9 कारणों से मध्यम से गंभीर समस्याएं होती हैं। जन्मजात हृदय दोष जन्म दोष से संबंधित मौतों का प्रमुख कारण हैं। 2015 में उन्होंने 1 99 0 में 366,000 मौतों से 303,300 मौतों की कमी की
।इसके अंतर्गत तीन रोग दिखाई पडते है- 1 patent foramen ovalis 2 patent ductus arteriosis 3 derective inter verticular septum इन तीनो को सामुहिक रूप से Blue baby disease भी कहते है( Narendra )
लक्षण और लक्षण
संपादित करेंलक्षण और लक्षण हृदय दोष के प्रकार और गंभीरता से संबंधित हैं। लक्षण अक्सर जीवन में शुरुआती उपस्थित होते हैं, लेकिन कुछ सीएचडी के लिए पूरे जीवन में ज्ञात नहीं होना संभव है। कुछ बच्चों के पास कोई संकेत नहीं है जबकि अन्य सांस की श्वास, साइनोसिस , फैनिंग , दिल की कुरकुरा , अंगों और मांसपेशियों के विकास, खराब भोजन या वृद्धि, या श्वसन संक्रमण का प्रदर्शन कर सकते हैं। जन्मजात हृदय दोष असामान्य हृदय संरचना का कारण बनते हैं जिसके परिणामस्वरूप दिल की कुरकुरा नामक कुछ ध्वनियों का उत्पादन होता है । इन्हें कभी-कभी संभोग द्वारा पता लगाया जा सकता है ; हालांकि, सभी दिल की शिकायतें जन्मजात हृदय दोषों के कारण नहीं होती हैं।
एसोसिएटेड लक्षण
जन्मजात हृदय दोष कुछ अन्य लक्षणों की वृद्धि हुई घटनाओं से जुड़े होते हैं, जिन्हें एक साथ वीएसीटीईआरएल एसोसिएशन कहा जाता है :
वी - वर्टीब्रल विसंगतियां
ए - गुदा एट्रेसिया
सी - कार्डियोवैस्कुलर विसंगतियां
टी - ट्रकीओईसोफैजीएल फिस्टुला
ई - एसोफेजियल एट्रेसिया
आर - रेनल (किडनी) और / या रेडियल विसंगतियां
एल - अंग दोष
वेंट्रिकुलर सेप्टल दोष (वीएसडी), एट्रियल सेप्टल दोष, और फॉलोट का टेट्रालॉजी वीएसीटीईआरएल एसोसिएशन में देखा जाने वाला सबसे आम जन्मजात हृदय दोष है। एसोसिएशन में कम आम दोष त्रुंकस धमनी और महान धमनियों के पारदर्शिता हैं।
कारण
संपादित करेंजन्मजात हृदय रोग का कारण आनुवांशिक, पर्यावरण या दोनों का संयोजन हो सकता है।
अनुवांशिक
संपादित करेंजन्मजात हृदय रोग के अधिकांश ज्ञात कारण स्पोरैडिक जेनेटिक परिवर्तन हैं, या तो फोकल उत्परिवर्तन या डीएनए के खंडों को हटाने या जोड़ना। सीआरडी के 21-8 % मामलों के कारण त्रिकोणीय 21 , 13 , और 18 जैसे बड़े गुणसूत्र असामान्यताएं , ट्राइसोमी 21 सबसे आम अनुवांशिक कारण हैं। छोटे गुणसूत्र असामान्यताएंअक्सर जन्मजात हृदय रोग का कारण बनती हैं, और उदाहरणों में क्रोमोसोम 22 (22q11, डिजीर्ज सिंड्रोम ) की लंबी बांह, गुणसूत्र 1 (1q21) की लंबी बांह , की छोटी शाखा का माइक्रोडलेक्शन शामिल है क्रोमोसोम 8 ( 8 पी 23) और जीनोम के कई अन्य, कम आवर्ती क्षेत्र, जैसा कि उच्च रिजोल्यूशन जीनोम-वाइड स्क्रीनिंग ( ऐरे तुलनात्मक जीनोमिक हाइब्रिडाइजेशन ) द्वारा दिखाया गया है ।
जटिल विकास अनुक्रम को विनियमित करने वाले जीन केवल आंशिक रूप से स्पष्ट किए गए हैं। कुछ जीन विशिष्ट दोषों से जुड़े होते हैं। कार्डियक अभिव्यक्तियों के साथ कई जीन जुड़े हुए हैं। हृदय की मांसपेशी प्रोटीन के उत्परिवर्तन, α-मायोसिन भारी श्रृंखला ( MYH6 ) एट्रियल सेप्टल दोषों से जुड़े होते हैं। कई प्रोटीन जो MYH6 के साथ बातचीत करते हैं, वे हृदय संबंधी दोषों से भी जुड़े होते हैं। ट्रांसक्रिप्शन कारक GATA4 टीबीएक्स 5 के साथ एक जटिल बनाता हैजो MYH6 के साथ इंटरैक्ट करता है। एक और पहलू, होमोबोक्स (विकास) जीन, NKX2-5MYH6 के साथ भी बातचीत करता है। इन सभी प्रोटीनों के उत्परिवर्तन एट्रियल और वेंट्रिकुलर सेप्टल दोष दोनों से जुड़े होते हैं; इसके अलावा, एनकेएक्स 2-5 दिल की विद्युत चालन में दोषों से जुड़ा हुआ है और टीबीएक्स 5 होल्ट-ओराम सिंड्रोमसे संबंधित है जिसमें विद्युत चालन दोष और ऊपरी अंग की असामान्यताएं शामिल हैं। एक और टी-बॉक्स जीन, टीबीएक्स 1, वेल्लो -कार्डियो-चेहरे सिंड्रोम डिजीर्ज सिंड्रोम में शामिल है , सबसे आम विलोपन जिसमें फ्लोरोट के टेट्रालॉजी सहित हृदय संबंधी बहिर्वाह पथ के दोष सहित व्यापक लक्षण हैं ।
जीन उत्पादों और संबंधित सुविधाओं के उदाहरण
MYH6 GATA4 NKX2-5 TBX5 TBX1
ठिकाना
14q11.2-Q13 8p23.1-p22 5q34 12q24.1 22q11.2
सिंड्रोम
होल्ट-ओरम
दीजोर्ज
एट्रियल सेप्टल दोष ✔ ✔ ✔ ✔
वेंट्रिकुलर सेप्टल दोष ✔ ✔ ✔
विद्युत चालन असामान्यताएं ✔ ✔
बहिर्वाह पथ असामान्यताओं ✔
गैर कार्डियक अभिव्यक्तियां[1 9]
ऊपरी अंग असामान्यताएं छोटे या अनुपस्थितथाइमस
छोटे या अनुपस्थित पैराथाइरॉइड
चेहरे असामान्यताओं
आण्विक मार्ग
पायदान संकेतन मार्ग , कोशिका वृद्धि और भेदभाव के लिए एक नियामक तंत्र, हृदय विकास के कई पहलुओं में व्यापक भूमिका निभाता है। शरीर की योजना के दाएं और बाएं किनारों के निर्धारण में पायदान तत्व शामिल होते हैं, इसलिए हृदय ट्यूब की दिशात्मक तहखाने पर असर पड़ सकता है। एंडोक सिग्नलिंग एंडोकार्डियल कुशन के गठन में जल्दी शामिल है और सेप्टा और वाल्व में विकसित होने के रूप में सक्रिय है। यह वेंट्रिकुलर दीवार के विकास और महान जहाजों के बहिर्वाह पथ के कनेक्शन में भी शामिल है। पायदान में से एक के लिए जीन में उत्परिवर्तन, जगदीड 1 , धमनीविरोधी डिस्प्लेसिया (अलागिल सिंड्रोम) के अधिकांश मामलों में पहचाने जाते हैं), महान जहाजों (फुफ्फुसीय धमनी स्टेनोसिस), दिल ( 13% मामलों में फलोट का टेट्रालॉजी ), यकृत, आंखें, चेहरे और हड्डियों के दोषों की विशेषता है । हालांकि सभी मामलों में, जहां कोई दोष में पाए जाते हैं की 1% से कम जैग्गड1 जीन, दोष में पाए जाते हैं नोटच2 जीन। 10% मामलों में, जीन में कोई उत्परिवर्तन नहीं मिलता है। जीन परिवार के दूसरे सदस्य के लिए , नोटच1 जीन में उत्परिवर्तन बाइकसपिड महाधमनी वाल्व से जुड़े होते हैं, तीन वाल्व के साथ दो पुस्तिकाओं के साथ एक वाल्व। नोटच 1 महाधमनी वाल्व के कैलिफ़िकेशन से भी जुड़ा हुआ है, वयस्कों में दिल की बीमारी का तीसरा सबसे आम कारण है।
एक सेल नियामक तंत्र के उत्परिवर्तन, रास / मापक मार्ग सहित काडिओफाकियकतानूस सिंड्रोम, की एक किस्म के लिए जिम्मेदार हैं नूनन सिंड्रोम , तेंदुए सिंड्रोम , कॉस्टेलो सिंड्रोम और
सिंड्रोम , जिसमें हृदय की भागीदारी होती है। जबकि सूचीबद्ध स्थितियों को अनुवांशिक कारण ज्ञात हैं, वहीं कई अन्य जीन हैं जो अधिक सूक्ष्म हैं। यह ज्ञात है कि जन्मजात हृदय दोषों का जोखिम अधिक होता है जब एक के साथ घनिष्ठ संबंध होता है।
पर्यावरण
संपादित करेंज्ञात पर्यावरणीय कारकों में गर्भावस्था के दौरान कुछ संक्रमण शामिल हैं जैसे रुबेला , ड्रग्स ( अल्कोहल , हाइडेंटोइन , लिथियम और थैलिडोमाइड ) और मातृ बीमारी ( मधुमेह मेलिटस , फेनिलकेक्टोनुरिया , और सिस्टमिक ल्यूपस एरिथेमैटोसस )।
होने के नाते अधिक वजन या मोटापे से ग्रस्त बढ़ जाती है जन्मजात हृदय रोग का खतरा। इसके अतिरिक्त, जैसे मातृ मोटापा बढ़ता है, हृदय दोषों का खतरा भी बढ़ जाता है। मातृ मोटापा और सीएचडी के बीच संबंधों को समझाने के लिए एक अलग शारीरिक तंत्र की पहचान नहीं की गई है, लेकिन कुछ अध्ययनों में प्रीपेगेंसी फैलोटे की कमी और मधुमेह दोनों को शामिल किया गया है।
घटनाओं का एक जटिल अनुक्रम है जिसके परिणामस्वरूप किसी भी हिस्से के जन्म और व्यवधान में एक अच्छी तरह से गठित दिल का परिणाम हो सकता है। कोशिका विकास, सेल माइग्रेशन, और प्रोग्राम किए गए सेल मौत (" एपोप्टोसिस ") के व्यवस्थित समय का व्यापक अध्ययन किया गया है और प्रक्रिया को नियंत्रित करने वाले जीनों को स्पष्ट किया जा रहा है। विकास के लगभग 15 दिन, कोशिकाएं जो हृदय बन जाएंगी, मध्य ऊतक परत ( मेसोदर्म) के दो घोड़े के आकार के बैंड में मौजूद होती हैं , और कुछ कोशिकाएं बाहरी परत ( एक्टोडर्म ) के एक हिस्से से माइग्रेट होती हैं , तंत्रिका शिखा, जो पूरे शरीर में पाए जाने वाले विभिन्न प्रकार के कोशिकाओं का स्रोत है। विकास के दिन 1 9, संवहनी तत्वों की एक जोड़ी, "एंडोकार्डियल ट्यूब", रूप। ट्यूबों का फ्यूज तब होता है जब पहले कोशिका क्षेत्र से प्रोग्राम किए गए मौत और कोशिकाओं से गुजरने वाली कोशिकाएं ट्यूब में माइग्रेट होती हैं, और दिन 21 तक हृदय कोशिकाओं ( मायोसाइट्स ) की एक अंगूठी बनाती हैं। 22 दिन, दिल को हराया जाता है और दिन 24, रक्त फैल रहा है।
22 दिन, परिसंचरण तंत्र प्रत्येक तरफ जोड़े वाले जहाजों के साथ द्विपक्षीय रूप से सममित होता है और हृदय शरीर लेआउट की मध्य रेखा में स्थित एक साधारण ट्यूब से युक्त होता है। भाग जो एट्रिया बन जाएंगे और सिर के सबसे नज़दीकी स्थित होंगे, वे सिर से सबसे दूर हैं। 23 से 28 दिनों तक, हृदय ट्यूब फोल्ड और मोड़, भविष्य के वेंट्रिकल्स केंद्र के बाईं ओर (दिल के अंतिम स्थान) और एट्रिया सिर की ओर बढ़ते हुए चलते हैं।
28 दिन, हृदय ट्यूब में ऊतक के क्षेत्रों में विस्तार करना शुरू होता है; लगभग दो हफ्तों के बाद, इन विस्तारों, झिल्लीदार " सेप्टम प्राइम " और मांसपेशियों " एंडोकार्डियल कुशन ", दिल के चार कक्ष बनाने के लिए फ्यूज। ठीक से फ्यूज करने में विफलता के परिणामस्वरूप एक दोष होगा जो रक्त को कक्षों के बीच रिसाव की अनुमति दे सकता है। ऐसा होने के बाद, तंत्रिका क्रीस्ट से माइग्रेट की जाने वाली कोशिकाएं बल्बस कॉर्डिस को विभाजित करने लगती हैं , मुख्य बहिर्वाह पथ दो सर्पिल सेप्टम के विकास से विभाजित होता है, जो महान जहाजों बनता है-महाधमनी और फुफ्फुसीय ट्रंक का आरोही भाग बन जाता है। यदि अलगाव अधूरा है, तो परिणाम एक "लगातार ट्रंकस धमनी" है। जहाजों को उलट दिया जा सकता है ("")। विभाजित पथ के दो हिस्सों को उचित वेंट्रिकल्स पर सही स्थिति में स्थानांतरित करना चाहिए। विफलता के परिणामस्वरूप कुछ रक्त गलत जहाज में बहते हैं ( उदाहरण के लिए महाधमनी ओवरराइडिंग )। चार-कक्ष वाले दिल और महान जहाजों में विशेषताएं हैं फेफड़ों के विकास के लिए जरूरी है। फेफड़े अप्रत्याशित होते हैं और पूर्ण परिसंचरण मात्रा को समायोजित नहीं कर सकते हैं। फेफड़ों से रक्त प्रवाह को दूर करने के लिए दो संरचनाएं मौजूद हैं। सेप्टम के हिस्से में कोशिकाएं मर जाती हैं जबकि मांसपेशियों की कोशिकाओं, " सेप्टम सेकंडम ", एक क्षेत्र को छोड़कर दाएं एट्रियल तरफ सेप्टम प्राइम के साथ बढ़ो, जिससे एक अंतर निकलता है जिसके माध्यम से दाएं आर्टियम से बाएं आलिंद, फोरामन ओवल तक गुजर सकता है । एक छोटा पोत, डक्टस धमनीफुफ्फुसीय धमनीसे रक्त को महाधमनी तक जाने की अनुमति देता है।
जन्म में परिवर्तन
संपादित करेंप्रोस्टाग्लैंडिन समेत फैक्टर फैलाने के कारण डक्टस आर्टिरियसस खुला रहता है । फोरामन ओवल दाएं आलिंद से बाएं आलिंद से रक्त के प्रवाह की वजह से खुला रहता है। फेफड़ों का विस्तार होने के कारण, फेफड़ों के माध्यम से रक्त आसानी से बहता है और मांसपेशियों के हिस्से (सेप्टम सेकेंडम) पर फोरामन ओवाले (सेप्टम प्राइम) के झिल्लीदार हिस्से का झुकाव होता है। अगर बंद अधूरा है, तो परिणाम पेटेंट फोरामन ओवल है । दो फ्लैप्स फ्यूज हो सकते हैं, लेकिन कई वयस्कों में फोरामन ओवाले होता है जो केवल एट्रिया के बीच दबाव अंतर के कारण बंद रहता है।
सिद्धांतों को
संपादित करेंरोकिटांस्की (1875) ने विभिन्न ऑटोजेनेसिस चरणों में हृदय विकास में ब्रेक के रूप में जन्मजात हृदय दोषों को समझाया । स्पिट्जर (1 9 23) उन्हें फिलाोजेनेसिस चरणों में से एक को रिटर्न के रूप में मानता है । क्रिम्स्की (1 9 63), दो पिछले बिंदुओं को संश्लेषित करते हुए, जन्मजात हृदय रोगों को ऑनोजेोजेनेसिस के कुछ चरण में विकास के एक स्टॉप के रूप में माना जाता है, जो इस या उस चरण के चरणबद्ध होता है। इसलिए ये सिद्धांत केवल महिलाओं और तटस्थ प्रकार के दोषों को समझा सकते हैं।
उपचार
संपादित करेंज्यादातर समय सीएचडी गंभीर है और सर्जरी और / या दवाओं की आवश्यकता होती है। दवाओं में मूत्रवर्धक शामिल हैं, जो दिल के संकुचन को मजबूत करने के लिए पानी, नमक और डिगॉक्सिन को समाप्त करने में शरीर की सहायता करते हैं। यह दिल की धड़कन धीमा करता है और ऊतकों से कुछ तरल पदार्थ हटा देता है। कुछ दोषों को परिसंचरण को सामान्य में वापस बहाल करने के लिए शल्य चिकित्सा प्रक्रियाओं की आवश्यकता होती है और कुछ मामलों में, कई सर्जरी की आवश्यकता होती है।
हस्तक्षेप कार्डियोलॉजी अब रोगियों को कुछ रोगियों के लिए शल्य चिकित्सा के लिए कम से कम आक्रामक विकल्प प्रदान करता है। 2006 में यूरोप में और अमेरिका में मानवतावादी डिवाइस छूट (एचडीई) के तहत यूरोप में अनुमोदित मेलोडी ट्रांसकेथेटर पल्मोनरी वाल्व (टीपीवी) को जन्मजात हृदय रोगियों के रोगियों के इलाज के लिए डिज़ाइन किया गया है, जो उनके दाएं वेंट्रिकुलर आउटफ्लो ट्रैक्ट (आरवीओटी) में एक निष्क्रिय संवहनी के साथ हैं। । आरवीओटी दिल और फेफड़ों के बीच संबंध है; एक बार रक्त फेफड़ों तक पहुंच जाता है, यह शरीर के बाकी हिस्सों में पंप होने से पहले ऑक्सीजन से समृद्ध होता है। ट्रांसकैथेटर फुफ्फुसीय वाल्व प्रौद्योगिकी एक असफल आरवीओटी कंड्यूट के जीवन को बढ़ाने के लिए एक कम आक्रामक माध्यम प्रदान करती है और रोगी के रक्त वाहिकाओं के माध्यम से चिकित्सकों को कैथेटर के माध्यम से प्रतिस्थापन फुफ्फुसीय वाल्व देने की अनुमति देने के लिए डिज़ाइन की गई है।
अधिकांश रोगियों को आजीवन विशेष कार्डियक देखभाल की आवश्यकता होती है, पहले एक बाल रोगी रोग विशेषज्ञ के साथ और बाद में वयस्क जन्मजात कार्डियोलॉजिस्ट के साथ। जन्मजात हृदय दोषों के साथ 1.8 मिलियन से अधिक वयस्क रहते हैं।
शब्दावली
संपादित करेंजन्मजात हृदय दोषों को जन्मजात हृदय विसंगति, जन्मजात हृदय रोग, हृदय दोष, और जन्मजात कार्डियोवैस्कुलर विकृतियों सहित कई नामों से जाना जाता है।
सन्दर्भ
संपादित करें- ↑ Hoffman JI, Kaplan S (June 2002). "The incidence of congenital heart disease". J. Am. Coll. Cardiol. 39 (12): 1890–900. PMID 12084585. डीओआइ:10.1016/S0735-1097(02)01886-7.
- ↑ अ आ सन्दर्भ त्रुटि:
<ref>का गलत प्रयोग;NIH2011Symनाम के संदर्भ में जानकारी नहीं है। - ↑ अ आ इ सन्दर्भ त्रुटि:
<ref>का गलत प्रयोग;WHO2011नाम के संदर्भ में जानकारी नहीं है। - ↑ सन्दर्भ त्रुटि:
<ref>का गलत प्रयोग;NIH2011Caनाम के संदर्भ में जानकारी नहीं है। - ↑ सन्दर्भ त्रुटि:
<ref>का गलत प्रयोग;Dean2014नाम के संदर्भ में जानकारी नहीं है। - ↑ सन्दर्भ त्रुटि:
<ref>का गलत प्रयोग;NIH2011Txनाम के संदर्भ में जानकारी नहीं है। - ↑ सन्दर्भ त्रुटि:
<ref>का गलत प्रयोग;NIH2011नाम के संदर्भ में जानकारी नहीं है। - ↑ GBD 2015 Disease and Injury Incidence and Prevalence, Collaborators. (8 October 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1545–1602. PMID 27733282. डीओआइ:10.1016/S0140-6736(16)31678-6. पी॰एम॰सी॰ 5055577.
- ↑ GBD 2015 Mortality and Causes of Death, Collaborators. (8 October 2016). "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1459–1544. PMID 27733281. डीओआइ:10.1016/s0140-6736(16)31012-1. पी॰एम॰सी॰ 5388903.
- ↑ ""What Are Congenital Heart Defects?"". मूल से 13 अगस्त 2015 को पुरालेखित.
|firstlast=missing|lastlast=in first (मदद) - ↑ "Global Atlas on Cardiovascular Disease Prevention and Control (PDF)" (PDF). मूल से 17 अगस्त 2014 को पुरालेखित (PDF).
|firstlast=missing|lastlast=in first (मदद) - ↑ "Global Atlas on Cardiovascular Disease Prevention and Control" (PDF). मूल से 17 अगस्त 2014 को पुरालेखित (PDF).
|firstlast=missing|lastlast=in first (मदद) - ↑ ""Preconception care: nutritional risks and interventions". Reproductive health".
- ↑ ""How Are Congenital Heart Defects Treated?". मूल से 22 अक्तूबर 2018 को पुरालेखित.