जीन चिकित्सा
कोशिकाओं और ऊतकों में किसी जीन की प्रविष्टि कराकर किसी बीमारी की चिकित्सा करना जीन चिकित्सा है, जैसे कि वंशानुगत बीमारी को ठीक करने के लिए उसका कारण बनने वाले किसी घातक उत्परिवर्ती एलील को किसी क्रियाशील जीन से प्रतिस्थापित करना. हालांकि यह विवादास्पद है, लेकिन जीन चिकित्सा से किसी व्यक्ति का जीन समीकरण और कार्य बदल कर उसमें वांछित लक्ष्य की दिशा में मनचाहे बदलाव लाये जा सकते और इससे मानव का आनुवंशिक विकास किया जा सकता है। यद्यपि यह तकनीक अपनी प्रारंभिक अवस्था में है, इसके प्रयोग में कुछ सफलता प्राप्त हुई है और विज्ञान के क्षेत्र में इसने समस्याओं के कुछ नए और प्रभावी समाधान दिए हैं, जिनकी वजह से जीन चिकित्सा मुख्यधारा की चिकित्सा की और बढ़ती जा रही है। प्रतिसंवेदी उपचार सिर्फ और सिर्फ जीन चिकित्सा नहीं है, बल्कि ये आनुवंशिक-मध्यस्थता से चिकित्सा की पद्धति है जिसे अक्सर दूसरे तरीकों के साथ प्रयोग किया जाता है।
जीन चिकित्सा प्रक्रिया के लिए पहली बार लोगों की स्वीकृति पाने का रास्ता बहुत ही कठोर और विवादों से भरा हुआ था। मानव जीन चिकित्सा का विज्ञान बहुत जटिल है और इसमें कई तकनीकें ऐसी है जिन्हें अभी और विकसित किया जाना है, कई और रोग ऐसे हैं जिन्हें अभी पूरी तरह समझने की ज़रुरत है ताकि जीन चिकित्सा को सही ढंग से प्रयोग किया जा सके. आनुवंशिक रूप से अभियन्त्रित पदार्थ को मानव में संभावित प्रयोग किया जाना चाहिए या नहीं इस पर सार्वजनिक नीति क्या हो इस पर होने वाली बहस भी उतनी ही जटिल है। जीव विज्ञान, सरकार, कानून, चिकित्सा, दर्शन, राजनीति और धर्म- इन सभी क्षेत्रों से जुड़े लोग इस चर्चा का हिस्सा रहे हैं और सभी ने चर्चा में एक नया दृष्टिकोण सामने रखा है।[उद्धरण चाहिए]
जीन को सीधे मानव कोशिकाओं में प्रवेश कराने का प्रयास कर वैज्ञानिकों ने एक तार्किक कदम उठाया. यह मुख्यतः केन्द्रित था ऐसी बीमारियों पर जो कि किसी एक ही जीन की गड़बड़ी से पैदा होती है, जैसे कि पूटीय तंतुशोथ, हीमोफिलिया, मांसपेशीय कुपोषण और सिकल सेल एनीमिया या अरक्तताहालाँकि, ये सामान्य बैक्टीरिया को संशोधित करने से कहीं ज्यादा कठिन है, प्राथमिक रूप से इसलिए क्योंकि डीएनए के बड़े-बड़े हिस्से लेकर उन्हें अपेक्षाकृत रूप से बड़े मानव जीनोम में सही जगह पर डालना काफी समस्या पूर्ण है।[उद्धरण चाहिए] आज, जीन चिकित्सा का ज़्यादातर ध्यान कैंसर और आनुवंशिक जीनीय बीमारियों पर केन्द्रित है।
जीन चिकित्सा में मामले का अध्ययन
संपादित करेंअशांति की जीन चिकित्सा प्रक्रिया में डॉक्टरों ने बच्ची के शरीर से सफेद रक्त कोशिकाओं को निकालकर उन कोशिकाओं को प्रयोगशाला में विकसित किया, उन कोशिकाओं में वो जीन डाला जिसकी उसमें कमी थी और उसके बाद जैविक रूप से संशोधित उन रक्त कोशिकाओं को मरीज़ के रक्त प्रवाह में वापस डाल दिया. इस बात की पुष्टि नहीं हो सकी है कि ये चिकित्सा अशांति की प्रतिरक्षा प्रणाली को बढा पाई है या नहीं, क्योंकि अध्ययन में कोई नियंत्रण भुजा यानि कंट्रोल आर्म नहीं थी और पूरे अध्ययन के दौरान उसे अपनी स्थिति के लिए मानक चिकित्सा मिलती रही.इसके अलावा, सफेद रक्त कोशिकाएं केवल कुछ ही महीनो तक कारगर रह सकती हैं, उसके बाद इस प्रक्रिया को दोहराना आवश्यक है (VII, थोमसन [प्रथम]1993). 2007 की शुरुआत तक उसका स्वास्थ अच्छा था और वो कॉलेज जाया करती थी। कुछ लोगों का कहना है कि अनिश्चित परिणामों के बावजूद अध्ययन का बहुत महत्व है, केवल इसलिए क्योंकि ये प्रतिपादित करता है कि जीन चिकित्सा को बिना किसी बुरे परिणाम के अभ्यासिक तौर पर किया जा सकता है[1]
जीन चिकित्सा के प्रकार
संपादित करेंजीन चिकित्सा को निम्न प्रकारों में वर्गीकृत किया जा सकता है:
जनन रेखा जीन चिकित्सा
संपादित करेंजनन रेखा जीन चिकित्सा के मामले में, जनन कोशिकाओं यानि कि शुक्राणु या अंडाणु में ऐसे क्रियाशील जीनों को डालकर संशिधित किया जाता है, जोकि आमतौर पर उनके जीनोमों में संकलित रहते हैं। इसलिए, चिकित्सा के कारण हुए परिवर्तन आनुवंशिक होंगे और आगे आने वाली पीढियों को प्राप्त होंगे. ये नवीन दृष्टिकोण, सैद्धांतिक रूप से, आनुवंशिक विकारों और वंशानुगत रोगों का प्रतिकार करने में अत्यधिक प्रभावी होना चाहिए. हालांकि, भिन्न प्रकार के तकनीकी और नैतिक कारणों की वजह से कम से कम वर्तमान समय में कई क्षेत्रों में इस प्रयोग का मनुष्यों पर इस्तेमाल करना निषेध है[specify] [उद्धरण चाहिए]
दैहिक जीन चिकित्सा
संपादित करेंदैहिक जीन थेरेपी के मामले में, उपचारात्मक जीनो को मरीज़ कीदैहिक कोशिकाओं में स्थानांतरित किया जाता हैं। किसी भी प्रकार का परिवर्तन और प्रभाव किसी एक मरीज़ तक ही सीमित रहेगा है और ये वंशागत रूप से रोगी की अगली पीढियों में नहीं जाएगा.
व्यापक तरीके
संपादित करेंजीन चिकित्सा में लक्ष्य किये जाने वाले जीन को बदलने और और उसकी मरम्मत करने के लिए कई विभिन्न प्रकार के तरीके हैं।[2]
- एक अक्रिय जीन को बदलने के लिए एक सामान्य जीन, जीनोम के भीतर किसी भी अनिश्चित स्थान पर डाला जा सकता है। यह तरीका सबसे आम है।
- समजात पुनर्संयोजन के माध्यम से एक असामान्य जीन को एक सामान्य जीन से बदला जा सकती है।
- चयनात्मक प्रवृत्य उत्परिवर्तन के माध्यम से असामान्य जीन की मरम्मत की जा सकती है ताकि वो सामान्य ढंग से काम करने लगता है।
- एक विशेष जीन के व्यवस्थापन (उस हद तक जहां पर जीन को कार्यशील और अक्रिय किया जाता है) को बदला जा सकता है। '
- तर्कु स्थानांतरण का प्रयोग करके वो सम्पूर्ण माईटोकोंड्रीया हटा दिया जाता है, जिसमे दोषपूर्ण माईटोकोंड्रीयल डीएनएहै।
जीन चिकित्सा में वाहक
संपादित करेंवायरस
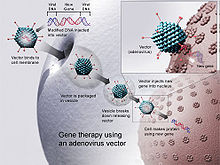
संपादित करेंसभी वायरस अपने भोजनदायी से बंधे हुए होते हैं और ये द्विगुणन या प्रतिकृति चक्र के एक हिस्से के दौरान अपनी आनुवंशिक सामग्री को भोजनदायी की कोशिका में छोड़ते हैं। यह आनुवंशिक सामग्री में इस बात के मूल 'निर्देश' दिए हुए होते हैं कि इस प्रकार के वायरसों की सामान प्रतियों को कैसे उत्पन्न करें और भोजनदायी के शरीर में उत्पादन के लिए प्रयोग होने वाले भोजनदायी के अंगो या यंत्रों को किस तरह चुराकर वायरस की ज़रूरतों को पूरा किया जाए. भोजनदायी की कोशिकाएं इन निर्देशों का पालन करेंगी और वायरसों की और प्रतियाँ उत्पन्न करेंगी, जिससे कि अधिक से अधिक और कोशिकाएं संक्रमित होंगी.वायरस के कुछ प्रकार के भौतिक रूप से भोजनदायी के जीनोम में अपने जीन डाल देते हैं, (यह रेट्रोवायरस की एक निर्धारक विशेषता है, जो की वायरस का वो परिवार है जिसमें शामिल हैं एचआईवी, इस परिवार के वायरस रिवर्स ट्रांसस्क्रिप्टेज एंजाइम को भोजनदायी में डाल देते हैं और फिर भोजनदायी का आर एन ए स्वयं इके लिए "निर्देश" का काम करता है). इससे जब तक कोशिका जीवित है तब तक उसके जीन में वायरस का जीन भी शामिल रहता है।
डॉक्टरों और आण्विक जीव विज्ञानियों ने एहसास किया है कि इस तरह के वायरस मानव कोशिका में अच्छे जीन के वाहक के तौर पर प्रयोग किये जा सकते हैं। सबसे पहले, एक वैज्ञानिक वायरस के उस जीन को हटायेंगे जो रोग का कारण है। तब वे उन जीनों को ऐसे जीनों से इनकोड या कूटबद्ध कर देते हैं जिनके प्रभाव वांछित हैं (उदाहरण के लिए, मधुमेह के मामले में इंसुलिन का उत्पादन) होगा. यह प्रक्रिया इस तरह से की जानी चाहिए कि जो जीन वायरस को भोजनदायी के जीनोम में प्रवेश करने की अनुमति देता है वह अखंडित रहे.यह भ्रामक है और इसे करने के लिए ज़रुरत है महत्वपूर्ण अनुसंधान और वायरस के जीन की समझ की ताकि ये पता चल सके की उनमें से हर जीन का कार्य क्या है। एक उदाहरण:
एक ऐसा वायरस पाया गया है, जो भोजनदायी की कोशिका के जीनोम में अपने जीन का प्रवेश कराता है और उसके बाद अपनी प्रतियाँ उत्पादित करता है। इस वायरस के दो जीनों हैं-ए और बी. ए जीन एक प्रोटीन को कूत्बधित करता है जो इस वायरस को ही मेजबान के जीनोम में प्रवेश करने की अनुमति देता है। जीन बी उस रोग का कारण है जिससे यह विषाणु जुदा है। जीन सी वह "सामान्य" या "वांछित" जीन है जिसे हम जीन बी की जगह पर चाहते हैं। इस तरह वायरस की ऐसी इंजीनियरिंग करके जिससे जीन बी, जीन सी द्वारा प्रतिस्थापित हो जाए और जीन ए सही ढंग से काम करता रहे, जीन सी को भोजनदायी की कोशिका में इस तरह डाला जा सकता है की कोई बीमारी उत्पन्न ना हो.
यह सब स्पष्ट रूप से एक अति साधारणीकृत रूप है और ऐसी कई समस्याएं मौजूद हैं जो जीन चिकित्सा में वायरल वाहक के प्रयोग को रोकती हैं, जैसे कि अनचाहे प्रभाव को रोकने कि परेशानी, यह सुनिश्चित करना कि वायरस शरीर में सही लक्ष्य कोशिका को संक्रमित करेगा और यह सुनिश्चित करना कि डाला गया जीनोम में पहले से उपस्थित किसी महत्वपूर्ण जीन को बाधित नहीं करेगा.हालांकि, जीन प्रवेश की मूल विधि में वर्तमान में काफी आशाजनक है। डॉक्टर और वैज्ञानिकों इस बात के लिए कड़ी मेहनत कर रहे हैं किसी भी संभावित समस्याओं को ठीक किया जा सके.
रेट्रोवायरस
संपादित करेंरेट्रोवायरस में आनुवंशिक सामग्री आरएनए अणुओं के रूप में होती है, जबकि उनके भोजनदायी की आनुवंशिक सामग्री के डीएनए के रूप में होती है। जब एक रेट्रोवायरस एक भोजनदायी कोशिका को संक्रमण करता है, तो यह अपने आरएनए को कुछ अन्य एंजाइमों के साथ भोजनदायी की कोशिका में छोड़ता है, ये एंजाइम हैं- रिवर्स ट्रांसक्रिप्टेस और इंटिग्रेस.भोजनदायी कोशिका की आनुवांशिक सामग्री में जुड़ने से पहले ज़रूरी है की रेट्रोवायरस के आरएनए अणु अपने आरएनए अणु से डीएनए की एक नकल बनाएं जो भोजनदायी कोशिका की आनुवांशिक सामग्री में जुड़ सके. एक आरएनए अणु से डीएनए की एक नकल बनाने की प्रक्रिया को विपरीत प्रतिलेखन कहा गया है। ये एक वायरस के अन्दर पाए जाने वाले एंजाइमों में से एक द्बारा किया जाता है जिसे रिवर्स ट्रांसस्क्रिप्टेज कहते है। जब ये डीएनए प्रति बन जाती है और भोजनदाई कोशिका के केन्द्रक में मुक्त रूप से पाई जाती है तो ज़रूरी है कि ये भोजनदाई कोशिका के जीनोम में शामिल हो जाए. इसका मतलब है कि यह कोशिका के बड़े डीएनए अणु (गुणसूत्र) में प्रवेश करे.यह प्रक्रिया वायरस में पाए जाने वाले एक दुसरे एंजाइम द्वारा की जाती है जिसे इंटिग्रेस कहा जाता है।
अब वायरस की आनुवंशिक सामग्री के अनुसार कहा जा सकता है कि भोजनदाई कोशिका अब एक नए जीन को धारण करने के लिए संशोधित कर डी गयी है। यदि यह भोजनदाई कोशिका बाद में विभाजित होती है, तो उसके वंश में सभी नई कोशिकाएं नए जीन को धारण करेंगी, कभी कभी रेट्रोवायरस के जीन उनकी जानकारी तुरंत व्यक्त नहीं करते.
जीन चिकित्सा में रेट्रोवायरस के प्रयोग की एक समस्या ये है कि इंटिग्रेस एंजाइम भोजनदायी कोशिका के जीनोम में उपस्थित वायरस जीनोम में मनमाने ढंग से किसी भी स्थिति में प्रवेश कर सकता है - और यह बेतरतीब ढंग से आनुवंशिक सामग्री को एक गुणसूत्र में बदल सकता है। यदि आनुवंशिक सामग्री भोजनदाई कोशिका के मूल जीनों में से एक के बीच में प्रवेश करे तो यह जीन बाधित हो जाएगा (अंतर्वेशन म्युटाजेनेसिस). यदि यह वो जीन है जो कोशिका विभाजन को नियंत्रित करता है तो इसके बाधित होने से कोशिका विभाजन अनियंत्रित हो सकता है (यानी, कैंसर). इस समस्या को हल करने के लिए हाल ही में जिंक फिंगर केन्द्रकों[3] का उपयोग शुरू हुआ या बीटा ग्लोबिन लोकस नियंत्रण क्षेत्र जैसे कुछ निश्चित अनुक्रमों के प्रयोग से जुड़ने के लिए गुणसूत्र के विशेष स्थानों पर निर्दिष्ट किया जाने लगा के एकीकरण के विशिष्ट गुणसूत्र साइटों के लिए साइट सीधे.
रेट्रोवायरल वाहक का प्रयोग करते हुए (X-SCID) लिंक वाले गंभीर प्रतिरक्षा अभाव का उपचार आज की तारीख तक जीन चिकित्सा के सबसे सफल प्रयोगों का उदाहरण है फ्रांस और ब्रिटेन में बीस से अधिक रोगियों का इलाज किया जा चूका है और उनमें तेज़ गति से प्रतिरक्षा प्रणाली का पुनर्गठन होता देखा गया है संयुक्त राज्य अमेरिका में इसी तरह के परीक्षण पर रोक लगा दी गई थी जब फ्रांसिसी मरीजों में रक्त कैंसर (ल्यूकेमिया) के इलाज के लिए X-SCID जीन चिकित्सा परीक्षण किया गया था। अब तक फ्रांस के चार और ब्रिटेन के एक बच्चे में रेट्रोवायरल वाहक द्वारा अंतर्वेशी म्युटाजेनेसिस की वजह से रक्त कैंसर (ल्यूकेमिया) विकसित हुआ है इनमें से एक को छोड़कर बाकी सभी बच्चों ने परंपरागत प्रति ल्यूकेमिया चिकित्सा के प्रति अच्छी प्रतिक्रिया दी है एडिनोसीन डायमिनेज़ (एडीए) एंजाइम की कमी से होने वाले SCID की चिकित्सा के लिए जीन चिकित्सा का प्रयोग करने के परीक्षण अमरीका, ब्रिटेन, इटली और जापान में अपेक्षाकृत सफलता से जारी है
एडिनोवायरस
संपादित करेंएडिनोवायरस वो वायरस हैं जिनकी आनुवंशिक सामग्री डीएनए के दोहरे धागे के रूप में होती है। ये मानव में श्वसन, आंत और नेत्र संक्रमण (खासकर आम ठंड) के संक्रमण का कारण बनते हैं। जब ये वायरस एक मेजबान कोशिका को संक्रमित, वे मेजबान में उनके डीएनए अणु परिचय. जब ये वायरस भोजनदायी कोशिका को संक्रमित करते हैं तो ये अपने डी एन ए अणु को भोजनदायी की कोशिका में प्रवेश करा देते हैं। एडिनोवायरस की आनुवंशिक सामग्री भोजनदायी की आनुवंशिक सामग्री में (अस्थायी रूप से भी) शामिल नहीं होती.डीएनए अणु भोजनदायी कोशिका के नाभिक में मुक्त छोड़ दिया जाता है और इस अतिरिक्त डीएनए अणु में जुड़े निर्देशों का प्रतिलेखन या ट्रांसक्रिप्शन ठीक उसी तरह होता है जैसे किसी दूसरे जीन का.फर्क सिर्फ इतना है कि ये अतिरिक्त जीन कोशिका विभाजन होने के समय द्विगुणित नहीं होते और इसलिए उत्तरदायी कोशिका में यह अतिरिक्त जीन नहीं होता. नतीजतन एडिनोवायरस के साथ उपचार में ज़रुरत होगी कि बढ़ती हुई कोशिका जनसंख्या का पुनः प्रबंधन किया जाए भले ही भोजनदायी कि कोशिका के जीनोम में जुडाव के आभाव के चलते कोशिका ऐसे कैंसर से बची रहेगी जिन्हें SCID परीक्षणों में देखा गया है। इस वाहक प्रणाली को कैंसर की चिकित्सा के लिए प्रोत्साहित किया गया है और दरअसल ये जीन चिकित्सा का पहला ऐसा उत्पाद है जिसे कैंसर के इलाज के लिए लाइसेंस प्राप्त है, गेंडीसिन एक एडिनोवायरस है। गेंडीसिन जो की एडिनोवायरस की पी53-आधारित एक जीन चिकित्सा पद्धति है उसे सिर और गर्दन के कैंसर के उपचार के लिए चीन के एफडीए द्वारा वार्स 2003 में अनुमोदित किया गया था। इसी से मिलती जुलती जीन चिकित्सा के एड्वेक्सिन को वर्ष 2008 में अमेरिका एफडीए द्वारा अस्वीकार कर दिया गया।
1999 में एक जीन चिकित्सा परीक्षण में भाग लेने वाली एरिजोना की एक किशोरी की मृत्यु के बाद एडिनोवायरस वैक्टर की सुरक्षा के बारे में चिंताएं जताई गयीं थीं। तब से, एडिनोवायरस वाहक के उपयोग में वायरस के आनुवंशिक रूप से अपंग रूपों पर जोर दिया गया है।
एडिनो से जुड़े वायरस
संपादित करेंपर्वोवायरस परिवार के,एडिनो से जुड़े वायरस एकल डीएनए के जीनोम वाले छोटे वायरस हैं। जंगली प्रकार का एएवी 100 प्रतिशत निश्चितता के साथ 19 वें गुणसूत्र की एक विशिष्ट जगह पर आनुवंशिक सामग्री का प्रवेश करा सकता है। लेकिन रीकॉम्बीनैंट एएवी जिसमें कोई भी वायरस जीन नहीं होता बल्कि सिर्फ उपचारात्मक जीन होता है, वह जीनोम में एकीकृत नहीं होता. इसके बजाय इसके सिरों पर पुनः संयोजक वायरल जीनोम आई टी आर (उल्टे अंतवाले दुहराव) पुंह संयोजन के ज़रिये वृत्ताकार संरचनाएं एपिसोम बनाता है, जिन्हें दीर्घकालिक जीन अभिव्यक्ति का प्राथमिक कारण माना जाता है। एएवी के प्रयोग में कुछ कमियां भी हैं, जिसमें शामिल है ये कि ये डीएनए की बहुत थोडी मात्र रखता है और इसे उत्पन्न करना काफी कठिन है। फिर भी इस प्रकार के वायरस का प्रयोग किया जाता है, क्योंकि यह गैर रोगजनक है। (ज्यादातर लोगों में यह हानिरहित वायरस पाया जाता है). एडिनोवायरस के विपरीत, एएवी से चिकित्सा लेने वाले ज्यादातर लोगों में प्रतिरक्षा प्रतिक्रिया स्वरुप वायरस और उसके द्वारा सफलतापूर्वक ठीक की गयी कोशिकाओं को हटाने के कोई प्रयास नहीं किये जाते.एएवी के साथ कई परीक्षण चल रहे हैं या उनकी तैयारी हो रही है, जो की मुख्य रूप से आँख और मांसपेशियों में होने वाली बीमारियों का इलाज करने की कोशिश कररहे हैं, यानि वो दो ऊतकों कहाँ वायरस विशेष रूप से उपयोगी प्रतीत होता है। हालाँकि, नैदानिक परीक्षण वहां भी शुरू किये गए हैं जहां एएवी वाहक मस्तिष्क को जीन प्रदान करने के किये प्रयोग किये जाते हैं। यह संभव है क्योंकि एएवी वायरस ऐसी कोशिकाओं को संक्रमित कर सकते हैं जो कि विभाजित नहीं हो रही (मौन), जैसे कि ऐसे न्यूरॉन्स जिनमें उनके जीनोम एक लंबे समय के लिए व्यक्त होते हैं
एन्वलप प्रोटीन, वायरल वाहक के छद्मरूप
संपादित करेंऊपर वर्णित वायरस वाहकों के पास ऐसी प्राकृतिक भोजनदायी कोशिका जनसंख्या होती है जिसे कि वे सबसे अधिक कुशलता से संक्रमित कर सकते है। रेट्रोवायरस की प्राकृतिक भोजनदायी कोशिकाएं एक सीमा तक ही सीमित है और हालांकि एडिनोवायरस और एडिनो-वायरस से जुड़े वायरस कोशिकाओं की एक अपेक्षाकृत व्यापक सीमा को कुशलता को संक्रमित कर सकते हैं, कुछ कोशिका प्रकार ऐसे भी हैं जो इन वायरसों के संक्रमण के लिए भी दुर्दम्य हैं। एक कोमल कोशिका से जुड़ना या उसमें प्रवेश करने में वायरस की सतह पर लगे प्रोटीन एन्वेलप द्वारा सहायता मिलती है। रेट्रोवायरस और एडिनो से जुड़े वायरस की झिल्ली पर प्रोटीन की एक एकल परत होती है, जबकि एडिनोवायरस की सतह पर एक एन्वेलप प्रोटीन और तंतु दोनों का आवरण होता है जो कि वायरस की सतह से दूर विस्तार कर रहा होता है। इन सभी वायरसों में से प्रत्येक में एन्वेलप प्रोटीनआवरण या एन्वेलप प्रोटीन कोशिका सतह अणुओं जैसे की हिपेरिन सल्फेट से जुड़े होते हैं, जो की उन्हें उनके सक्षम भोजनदायी के पास ले जाता है और साथ ही उनपर प्रोटीन ग्राहक भी होते हैं जो या तो वायरस के प्रोटीन में प्रवेश करने में प्रोत्साहन देने वाली संरचना को प्रेरित करते हैं या वायरस के इंडोसोमcell-surface moleculescell-surface moleculesकोशिका-सतह अणु को वहां पहुंचाते हैं जहाँ अवकाशिका की अम्लता वायरस के कोट को दोबारा मुड़ने यानि रीफोल्डिंग के लिए प्रेरित करती है। दोनों ही मामलों में, संभावित भोजनदायी कोशिका में प्रवेश के लिए वायरस की सतह पर पाए जाने वाले प्रोटीन और भोजनदायी कोशिका की सतह पर मौजूद प्रोटीन पर अनुकूल संपर्क की आवश्यकता होती है। जीन चिकित्सा के प्रयोजनों के लिए, ये वांछित हो सकता है कि एक जीन चिकित्सा वाहक द्वारा ग्रहणीय कोशिकाओं की सीमा बढ़ाई जाए.इसे समाप्त करने के लिए, कई वाहक विकसित किये गए हैं, जिनमें अंतर्जात वायरस एन्वेलप प्रोटीन या तो अन्य वायरसों के एन्वेलप प्रोटीन, या कैमेरिक प्रोटीन द्वारा प्रतिस्थापित किये गए हैं। ऐसे कायिमेरा में वायरस के प्रोटीन का वो हिस्सा होता है जो वायरियोन में शामिल होने के लिए ज़रूरी है और साथ ही वो अनुक्रम भी जो विशेष भोजनदायी कोशिका के प्रोटीन के साथ क्रिया करने के लिए ज़रूरी है। ऐसे वायरस जिनमें इस तरह के इन्वेलाप प्रोटीन परिस्थिति कर दिए जाते हैं उन्हें छद्म वायरस वायरस कहा जाता है उदाहरण के लिए, सबसे जाना माना रेट्रो वायरस जो की जीन चिकित्सा के परीक्षण हेतु कारगर माना जाता है लेंटी वायरस सिमियन प्रतिरक्षा अभाव वायरस है जो की फफोलेदार मुखपाक वायरस या वेसीक्युलर स्टोमेटायटिस वायरस से मिलने वाले जी प्रोटीन नामक एन्वेलप प्रोटीन के आवरण में होता है। इस वाहक को वी एस वी जी छद्म लेंटीवायरस के नाम से जाना जाता है और ये लगभग सभी कोशिकाओं को संक्रमित करता है। इसका यह गुण वी एस वी जी प्रोटीन के बिशेषता है जिससे कि ये वाहक ढंका होता है। वायरस वाहकों द्वारा सभी कोशिकाओं को संक्रमित करने कि इस क्षमता को सिर्फ एक या कुस्छ भोजनदायी कोशिकाओं को संक्रमित करने तक सीमित करने के लिए कई प्रयास किये गए हैं। यह विकास वाहकों कि अपेक्षाकृत काफी कम मात्र का यथाक्रम प्रशासन करने का अवसर देगा.अलक्षित कोशिकाओं के रूपांतरण कि क्षमता सीमित हो जायेगी और चिकित्सा समुदाय कि कई चिंताओं का निवारण हो जाएगा. सभी कोशिकाओं को संक्रमित करने के लिए किये गए ज़्यादातर प्रयासों में एंटीबॉडी अंशों वाले कायमेरिक एन्वेलप प्रोटीन का प्रयोग हुआ है। जीन चकित्सा कि "जादुई गोलियां" विकसित करने में ये वाहक काफी प्रतिबद्धता दिखाते है।
गैर वायरल प्रणाली
संपादित करेंवायरल की बजाय गैर वायरल पद्धति के अपने फायदे हैं, जिनमें से दो मुख्य फायदे तो ये हैं की इनका उत्पादन सरल है और भोजनदायी की प्रतिरक्षा उत्पत्ति की क्षमता यानि इम्म्यूनोजेनेसिटी का कम होना .पहले गैर वायरल पद्धति में जीन के ट्रांसफैक्शन यानी परा संक्रमण और अभीव्यक्ति के कम स्तर के कारण उसे खराब मन जाता था; जबकि वाहक तकनीक में हुए हालिया विकास ने इस पद्धति के ऐसे अणु और तकनीक पैदा कर दिए हैं जिनका परा संक्रमण वायरस के बराबर ही प्रभावी होता है।
नग्न डीएनए
संपादित करेंयह वायरस परा संक्रमण की सबसे सरल तकनीक है। नग्न डी एन ए प्लास्मिड के अन्तः मांस पेशीय अन्तः क्षेपण द्वारा किये गए चिकित्सीय परीक्षणों में कुछ सफलता मिली है, हालांकी, अभिव्यक्ति परसंक्रमण की अन्य पद्धतियों की तुलना में बहुत कम रही है। इसके अलावा प्लास्मिड के साथ परिक्षण में, नग्न पीसीआर परियोजना के साथ भी परिक्षण किये गए हैं जो कि लगभग बरबार या कुछ ज्यादा सफल रहे हैं। यह सफलता हालांकि अन्य पद्धतियों की तुलना में कुछ ख़ास नहीं रही जिससे कि नग्न डी एन ए को प्रदान करने के लिए इलेक्ट्रोपोरेशन, सोनोपोरेशन और 'जीन गन' जैसी बेहतर पद्धतियों हेतु अनुसंधान को बढावा मिला 'जीन गन' की सहायता से डी एन ए के आवारण में लिपटे सोने के कणों को उच्च गैसीय दाब की सहायता से कोशिका में दाग दिया जाता है।
ओलाईगोन्युक्लियोटाईड्स
संपादित करेंजीन चिकित्सा में संश्लेषित ओलईगोन्युक्लियोटाईड्स का प्रयोग बिमारी की प्रक्रिया में शामिल जीनों को अक्रिय करने में किया जाता है। ऐसे कई तरीके है जिसके द्वारा ये किया जाता है एक तरीका है दोषपूर्ण जीन के ट्रांसक्रिप्शन को बाधित करने के लिए लक्ष्य जीन के लिए विशेष प्रतिसंवेदी का उपयोग करना.दूसरा है - एस आई आर एन ए कहे जाने वाले आर एन ए के छोटे कणों का प्रयोग करके कोशिका को संकेत देना कि दोषपूर्ण जीन के एम् आर एन ए ट्रांसक्रिप्ट (प्रतिलेख) के विशिष्ट अनुक्रम को विभाजित कर दे ताकि दोषपूर्ण एम् आर एम् ए का रूपांतरण बाधित हो जाए और इस तरह, जीन कि अभिव्याक्ति भी बाधित हो जाए.इसके आगे एक और रणनीति है दोहरे धागे वाले ओलिगोडीऑक्सीन्यूक्लिओटाइड्स को फंदे की तरह प्रयोग करके उन प्रतिलेखन घटकों को फ़साना जो लक्ष्य जीन के प्रतिलेखन को शुरू करने के लिए ज़रूरी है। प्रतिलेखन घटक दोषपूर्ण जीन के सहायकों की बजाए फंडों से जुड़ जाते हैं और लक्ष्य जीन का प्रतिलेखन रुक जाता है तथा अभिव्यक्ति कम हो जाती है। इसके साथ ही, एकल धागे वाले डी एन ए ओलईगोन्युक्लियोटाईड्स एक उत्परिवर्ती जीन के साथ एक एकल आधार के परिवर्तन को निर्देशित करने के लिए प्रयोग किये जाते हैं। ओलईगोन्युक्लियोटाईड्स पूरी तरह लक्ष्य जीन के अनुसार पकने के लिए डिजाइन किया हुआ होता है सिवाय इसके कि मरम्मत के लिए पट्टी का कार्य करता है वह नहीं होता . इस तकनीक को ओलईगोन्युक्लियोटाईड्स मध्यस्थ जीन मरम्मत लक्ष्य जीन मरम्मत या लक्ष्य न्युक्लियोटाईड्स परिवर्तन के नाम से जाना जाता है।
==== लाइपोप्लेक्सेस और पॉलीप्लेक्सेस
====
कोशिका में नए डीएनए के वितरण में सुधार करने के लिए, डीएनए को किसी नुकसान से बचाया जाना चाहिए और कोशिका में उसकी प्रविष्टि सुविधाजनक होनी चाहिए.इसी के लिए नए अणु लाइपोप्लेक्सेस और पॉलीप्लेक्सेस बनाये जाते हैं, इनमें ये क्षमता होती है कि परसंक्रमण की प्रक्रिया के दौरान डी एन ए को अवांछनीय क्षय से सुरक्षित रखें.
प्लाज्मिड डीएनए मिसेल या एक लाइपोसोम एक संगठित ढांचे की तरह लिपिड के आवरण में रह सकता है। जब यह संगठित संरचना डीएनए के साथ मिश्रित होकर लाइपोसोम कही जाती है। लिपिड तीन प्रकार के होते हैं, ऋणात्मक (नकारात्मक आवेश वाले), उदासीन, या धनायनित (सकारात्मक आवेश वाले). शुरू में, संश्लेषित वाहकों के लिए लाइपोप्लेक्सेस के निर्माण में ऋणात्मक और उदासीन लिपिड का प्रयोग होता था। लेकिन बाद में, इन तथ्यों के बावजूद कि उनके साथ बहुत ही कम विषैलापन जुड़ा हुआ है, वह शारीरिक द्रवों के अनुकूल हैं और उन्हें ऊतक विशेष के अनुसार ढलने की सम्भावना है; क्योंकि वो जटिल हैं और बहुत ज्यादा समय लेते है, अतः लाइपोप्लेक्सेस के निर्माण के लिए ध्यान उनपर से हटाकर धनायनित रूपों पर लगाया गया।
अपने सकारात्मक आवेश के कारण धनायनित लिपिड का प्रयोग पहले ऋणात्मक डीएनए अणु को संघनित करने में होता था, ताकि उनकी डी एन ए एक कैप्सूल का रूप लेकर लाइपोसोम बन जाए. बाद में यह पाया गया कि धनायनित लिपिड लाइपोप्लेक्सेस की स्थिरता को काफी बाधा देते हैं। इसके अलावा अपने आवेश के कारण धनायनित लिपिड कोशिका झिल्ली के साथ क्रिया कर लेते हैं, व्यापक रूप से मन जाता था कि इंडोसाइटोसिस कोशिका द्वारा लाइपोसोम लेने का मुख्य मार्ग है। इंडोसाइटोसिस के परिणामस्वरुप इंडोसोम बनते हैं, लेकिन यदि जीन इंडो सोम की झिल्ली तोड़कर कोशिका द्रव्य में छोड़ा नहीं जा सकता, तो उन्हें लाइसोसोम में भेज दिया जाएगा जहाँ उनका कार्य पूरा करने से पहले सभी डीएनए नष्ट कर दिए जायेंगे.यह भी पाया गया कि यद्यपि धनायनित लिपिड स्वयं ही कैप्सूल रुपी डी एन ए को संघनित करके लाइपोसोम में बदल सकते हैं, लेकिन उनकी परा संक्रमण प्रभावशीलता बहुत कम है क्योंकि इंडोसोमीय निस्तार के मामले में उनकी क्षमता बहुत कम है। बहरहाल, लाइपोप्लेक्सेस बनाने के लिए जब सहायक लिपिड (आम तौर पर विद्युत उदासीन लिपिड जैसे की डीओपीई) जोड़े गए, तो कहीं अधिक परासंक्रमण प्रभावशीलता देखी गयी। बाद में यह पता लगा कि कुछ लिपिडों में ये क्षमता है कि वो इंडोसोम की झिल्ली को विस्थिरिकृत कर सकते है ताकि डीएनए इंडोसोम से बच सके, इसीलिए उन लिपिडों को फ्यूजोजेनिक लिपिड कहा जाता है। हालांकि धनायनित लाइपोसोम को व्यापक रूप से जीन वितरण वाहक़ या जीन डिलीवरी वैक्टर के एक विकल्प के रूप में प्रयोग किया जाता है, उनमें मात्र पर आधारित विषाक्तता भी पायी गयी, जिसकी वजह से उनका चिकित्सीय प्रयोग सीमित हो गया।
लाइपोप्लेक्सेस का सबसे आम प्रयोग है जीन कोशिका का कैंसर कोशिकाओं में स्थानांतरण, जहाँ आपूर्तित जीन कोशिका में ट्यूमर शमन करनेवाले नियंत्रण जीन को सक्रिय कर देता है और ओंकोजींस की सक्रियता कम हो जाती है। हाल के अध्ययन से पता चला है लाइपोप्लेक्सेस श्वसन उपकला कोशिकाओंको परासंक्रमित करने में उपयोगी है, अतः उनका प्रयोग पुटीय या सिस्टिक फाइब्रोसिस जैसे आनुवंशिक श्वसन रोगों की चिकित्सा में हो सकता है।
डीएनए के साथ पॉलिमर के जटिल मिश्रण को पॉलीप्लेक्सेस कहा जाता है। ज्यादातर पॉलीप्लेक्सेस धनायनित पॉलीमरों से मिलकर बनते हैं और उनका उत्पादन आयनिक अंतःक्रिया के फलस्वरूप होता है। पॉलीप्लेक्सेस और लाइपोप्लेक्सेस के कार्य की पद्धतियों में एक बड़ा अंतर ये है कि पोल्य्प्लेक्सेस अपने डीएनए भार को कोशिकाद्रव्य में मुक्त नहीं कर सकते, अतः इसके लिए इंडोलायटिक अभिकर्ताओं (पॉलीप्लेक्स के कोशिका में दाखिल होने की प्रक्रिया इंडोसाइटोसिस के दौरान बने इंडोसोम को नष्ट करने के लिए) जैसे कि एडिनो वायरस के साथ सह परासंक्रमण होना ज़रूरी है। बहरहाल, हमेशा बात यही नहीं होती, पॉलिमर जैसे कि पॉलीएथिलएमीन के पास इंडोसोम नष्ट करने के अपने तरीके होते है, जैसे कि काईटोसन और ट्राईमैथिलकाईटोसन में.
संकर तरीके
संपादित करेंजीन स्थानांतरण की हर विधि में पायी जाने वाली कमियों के कारण, ऐसे कुछ संकर तरीके भी विकसित किये गए हैं जो दो या और तरीको को मिलकर बनते हैं।वायरोसोम इसका एक उदाहरण हैं, जोकि लाइपोसोम को अक्रिय एचआईवी या इन्फ्लूएंजा वायरस के साथ जोड़ते हैं। इस तरीके से श्वसन उपकला कोशिकाओं में जीन स्थानांतरण सिर्फ वायरस या सिर्फ लाइपोसोम पद्धति की तुलना कहीं ज्यादा प्रभावी तरीके से होता देखा गया है। अन्य तरीकों में अन्य वायरल वाहकों को धनायनित लिपिडों या संकरित वायरस के साथ मिश्रित किया जाता है।
डेनड्रीमर
संपादित करेंडेनड्रीमर एक बहुशाखित दीर्घ अणु या मैक्रो मोलेक्यूल होता है जिसका आकर गोलीय होता है। कण की सतह कई मायनों में क्रियाशील बनायी जा सकती है और इसके परिणामस्वरूप बने फल के कई गुण उसकी सतह के आधार पर तय किये जाते हैं।
विशेष रूप से एक धनायनित डेनड्रीमर बनाना संभव है है यानि जिसकी सतह पर धनायनित आवेश हों.जब डीएनए या आरएनए जैसे आनुवंशिक पदार्थ की उपस्थिति में, आवेश की पूर्णता की आवश्यकता के चलते न्यूक्लिक अम्ल की धनायनित डेनड्रीमर के साथ अस्थायी जुडाव बनने लगते हैं। डेनड्रीमर न्यूक्लिक अम्ल संश्लेषण के अपने गंतव्य तक पहुँचने पर उसे इंडोसाइटोसिस के माध्यम से कोशिका के अन्दर ले लिया जाता है।
हाल के वर्षों में परा संक्रमण के अभिकर्मकों के न्यूनतम मानदंड धनायनित लिपिड ही रहे हैं। इन प्रतियोगी अभिकर्मकों की सीमाओं में शामिल हैं-कई तरह के कोशिका प्रकारों को परा संक्रमित करने की योग्यता की कमी, मज़बूत हमले करने की क्षमता की कमी, पशु नमूनों के प्रति असंगति और विशैलापन. डेनड्रीमर मजबूत सह-संयोजी निर्माण और अणु संरचना पर चरम नियंत्रण और इसलिए बड़े आकार प्रदान करते है। इनका एक साथ प्रयोग मौजूदा तरीकों की तुलना में जोरदार लाभ देता है।
डेनड्रीमर का उत्पादन ऐतिहासिक रूप से एक धीमी और महंगी प्रक्रिया है जिसमें कई मंद अभिक्रियाएँ और एक ऐसी बाधा है जिसने उनका व्यावसायिक विकास को काफी घटा दिया है। मिशिगन स्थित कंपनी डेनड्रीटिक नैनो टेक्नोलोजीस ने कायनेटिक या गतिकीय आधारित रसायन विज्ञानं के आधार पर डेनड्रीमर बनाने की एक पद्धति विकसित की, एक ऐसी पद्धति जिससे न सिर्फ प्रक्रिया की लागत तीन के परिमाण से घट गयी बल्कि अभिक्रिया पूरा होने का समय जोकि एक महीने से ऊपर था घटकर कई दिनों तक आ गया।
ये नए 'प्रायो स्टार" डेनड्रीमर विशेष रूप से डी एन ए या आर एन ए को धारण करने के लिए भी बनाये जा सकते हैं जो की कोशिकाओं को अधिक प्रभावी ढंग से बहुत कम या बिना किसी विषाक्तता के परासंक्रमित कर सकते है।
जीन चिकित्सा में मुख्य विकास
संपादित करें| यह section सूची के रूप में है। इसे गद्य के रूप में बेहतर दर्शाया जा सकता है। कृपया इसे सूची से गद्य रूप में ढाल कर इसे बेहतर बनाने में मदद करें। (September 2009) |
2002 और उसके पहले
संपादित करेंजीन चिकित्सा का नया तरीका संदेशवाहक या मैसेंजर आरएनए में दोषपूर्ण जीनो से व्युत्पन्न त्रुटियों की मरम्मत करता है। इस तकनीक में रक्त दोष थैलेसिमिया, पूटीय तंतुशोथ या सिस्टिक फाइब्रोसिस, और कुछ प्रकार की कैंसर की बीमारियों का इलाज करने की क्षमता है। NewScientist.com पर सटल जीन थिरेपी टैकल्स ब्लड डिसौर्डर (11 अक्टूबर 2002) देखें.
केस वेस्टर्न रिजर्व विश्वविद्यालय और कोपर्निकस चिकित्सा विज्ञान के अनुसंधानकर्ता ने 25 नैनो मीटर जितने सूक्ष्म लाइपोसोम बनाने में सफलता प्राप्त की जो चिकित्सीय डी एन ए को केन्द्रक झिल्ली के छिद्रों के पार ले जा सकता है।NewScientist.com पर डीएनए नैनो बॉल बूस्ट जीन थिरेपी देखें (12 मई 2002).
चूहों में सिकल सेल रोग का सफलतापूर्वक इलाज किया जाता है। 18 मार्च 2002 के द साइंटिस्ट संस्करण के में प्रकाशित म्यूरीन जीन थिरेपी करेक्ट्स सिम्टम्स ऑफ़ सिकल सेल डिजीज देखें.
वर्ष 2000 से बहु-केन्द्रीय ट्रायल में एस सी आई डी द्वारा बच्चों का सफल इलाज होता रहा है लेकिन वर्ष 2002 में उनसे सवाल पूछे गए जब ट्रायल के पेरिस केंद्र में 10 में से 2 बच्चों का इलाज हो रहा था तो उनके साथ रक्त कैंसर (ल्यूकेमिया) जैसी स्थिति पैदा हो गई थी। 2002 में नैदानिक परीक्षणों पर अस्थायी रूप से रोक लगा दी गई, लेकिन संयुक्त राज्य अमेरिका, यूनाइटेड किंगडम, फ्रांस, इटली और जर्मनी में प्रोटोकॉल की नियामक समीक्षा के बाद इसे फिर से शुरू कर दिया गया।[4]
1993 में प्रतिरक्षा अभाव(एस.सी.आई.डी.) के गंभीर संयोग से ग्रसित एंड्रयू गोबिया का जन्म हुआ। जन्म से पहले हुयी जीनीय जांच से पता चला कि उसे एस.सी.आई.डी. था। एंड्रयू की नाल और गर्भनाल से स्टेम कोशिकाओं वाला रक्त जन्म के तुंरत बाद निकाल दिया गया। वह एलील जो एडीए के लिए कोड करता है उसे प्राप्त किया गया और उसे रेट्रो वायरस में डाला गया। रेट्रोवायरस और नलिका कोशिकाएं आपस में मिलाई गयीं, उसके बाद उन्हें स्टेम कोशिका के जीन में प्रवेश कराकर उसके गुणसूत्रों से मिला दिया गया। क्रियाशील एडीए जीन वाली स्टेम कोशिकाओं को एंड्र्यू की रक्त प्रणाली में नसों के माध्यम से अन्दर डाला गया। उसे साप्ताहिक तौर पर एडीए एंजाइम के इंजेक्शन भी दिए गए। चार साल तक स्टेम कोशिकाओं द्वारा बनाई गयी टी-कोशिकाओं (श्वेत रक्त कोशिकाएं) ने एडीए जीन का प्रयोग करते हुए एडीए जीन बनाये. चार साल के बाद और उपचार की ज़रुरत पड़ी.
2003
संपादित करें2003 में कैलिफोर्निया विश्वविद्यालय, लॉस एंजिल्सकी अनुसंधान टीम ने पोलीएथीलीन ग्लाईकोल (पी.ई.जी.) नामक एक पोलीमर के आवरण वाले लाइपोसोम का प्रयोग करके जीनों को मस्तिष्क में डाला. मस्तिष्क में जीनों का स्थानांतरण एक महत्वपूर्ण उपलब्धि है क्योंकि वायरल वाहक "रक्त मस्तिष्क बाधा" को पार करने के लिए बहुत बड़े होते हैं। इस विधि मेंपार्किंसंस रोग का इलाज करने की क्षमता है। NewScientist.com में अंडरकवरजींस स्लिप इनटू द ब्रेन देखें.(20 मार्च 2003)
आरएनए हस्तक्षेप या जीन गुप्तता हंटिंग्टन के इलाज का एक नया तरीका हो सकता है। दोहरे धागे वाले आरएनए (इंटरफीयरिंग आरएनए या एसआई आरएनए के छोटे टुकड़े) का प्रयोग कोशिकाओं द्वारा आरएनए के अपघटन के लिए किया जाता है। यदि एक एस आई आरएनए को दोषपूर्ण जीन की नक़ल से बनाए गए आरएनए से सुमेलित करने के लिए डिज़ाइन किया जाता है तो असामान्य प्रोटीन उत्पाद है एक कॉपी किया है, तो उस जीन के असामान्य प्रोटीन उत्पाद का उत्पादन नहीं किया जाएगा. NewScientist.com में जीन थिरेपी में स्विच ऑफ हंटिंगटांस देखें (13 मार्च 2003).
2003
संपादित करेंस्वास्थ्य के राष्ट्रीय संस्थानों(बेथेस्डा, मेरीलैंड) के वैज्ञानिकों ने दो मरीजों में जीनीय रूप से पुनर्लाक्षित टी कोशिकाओं का प्रयोग करते हुए मेटास्टैटिक मेलोनोमा को सफलतापूर्वक ठीक किया। इस अध्ययन ने पहला संकेत दिया कि जीन थेरेपी कैंसर के उपचार में कारगर हो सकती है।[5]
मार्च 2003 में अंतरराष्ट्रीय समूह के वैज्ञानिकों ने घोषणा की कि दो वयस्क मरीजों को मीलोइड कोशिकाओं को प्रभावित करने वाली बीमारी में ठीक किया गया। ये अध्ययन नेचर मेडिसीन में प्रकाशित हुआ और ये मीलोइड प्रणाली की बीमारियों को ठीक करने के लिए जीन थिरेपी के कारगर होने का पहला प्रदर्शन किया।[6]
मई 2006 में डॉ॰ लुईगी नाल्दिनी और डॉ॰ ब्रायन ब्राउन के नेतृत्व में सैन रैफेल टेलीथन इंस्टिट्यूट फॉर जीन थेरेपी (एच एस आर- टीआईजीईटी) के वैज्ञानिकों ने मिलान,इटली में जीन चिकित्सा के क्षेत्र में एक नयी सफलता प्राप्त की जिसमें उन्होंने प्रतिरक्षा प्रणाली को एक नये वितरित जीन की अस्वीकार करने से रोक दिया.[7] अंग प्रत्यारोपण की ही तरह जीन चिकित्सा भी प्रतिरक्षा प्रणाली की अस्वीकृति होने की समस्या से ग्रस्त है। अभी तक 'सामान्य' जीन का वितरण कठिन रहा है क्योंकि प्रतिरक्षा प्रणाली नै जींस को पहचान लेती है और बाहरी जीन मानकर उन्हें धारण करने वाली कोशिकाओं को स्वीकार कर देती है। इस समस्या को दूर करने, एचएसआर- टीआईजीईटी समूह ने माइक्रो आर एन ए के नाम से जाने जाने वाले अणुओं द्वारा नियंत्रित नए आवरणरहित जीन जाल का प्रयोग किया। डॉ॰ नाल्दिनी के समूह ने तर्क दिया कि वो माइक्रो आर एन ए के प्राकृतिक फलन का प्रयोग करके चयनात्मक रूप से उपचारात्मक जीन की पहचान होने से रोक सकते हैं और इस तरह नष्ट किये जाने से बचा सकते हैं। शोधकर्ताओं ने एक प्रतिरक्षा कोशिका माइक्रो आरएनए लक्ष्य अनुक्रम को चूहे में डाल दिया और दर्शनीय रूप से, चूहे ने जीन को अस्वीकार नहीं किया, जैसा की पहले हो चुका था जब माइक्रो आर एन ए लक्ष्य अनुक्रम के बिना वाहकों का प्रयोग किया गया। इस कार्य का जीन चिकित्सा से हीमोफिलिया और अन्य आनुवांशिक रोगों के उपचार पर महत्वपूर्ण प्रभाव पड़ेगा.
2007
संपादित करें1 मई 2007 को मूरफील्ड आई हॉस्पिटल और यूनिवर्सिटी कॉलेज लंदन इंस्टिट्यूट ऑफ़ ओप्थाल्मोलोजी ने आनुवंशिक रेटिना की बीमारी के लिए पहली बार जीन चिकित्सा के परीक्षण की घोषणा की. इसका पहली प्रक्रिया 23 साल के एक ब्रिटिश पुरुष रॉबर्ट जॉनसन पर 2007 की शुरुआत में की गयी।[8] लेबर की जन्मजात अंधता एक आनुवंशिक अन्धता है जो कि आर पी ई 65 जीन में उत्परिवर्तन कि वजह से होती है। मूरफील्ड्स/यूंसीएल के प्रयासों के परिणाम न्यू इंग्लैंड जर्नल ऑफ मेडिसिन में अप्रैल, 2008 में प्रकाशित किए गए थे। उन्होंने आर पी ई 65 जीन को धारण करने वाले रीकोम्बिनेंट एडिनो संलग्न वायरस (ए ए वी) के उपरेटिनीय वितरण की सुरक्षा के लिए शोध किया और यह पाया कि इसके सकारात्मक परिणाम हैं, रोगियों कि दृष्टि में मामूली वृद्धि होने साथ शायद सबसे अधिक महत्वपूर्ण बात ये थी कि इसका कोई स्पष्ट दुष्प्रभाव नहीं हुआ था।[9]
समस्याएं और नैतिकता
संपादित करेंजीन चिकित्सा की सुरक्षा के लिए, वर्तमान सोच के अनुसार वीजमैन बाधा मौलिक है। इसलिए दैहिक से जनन प्रतिक्रिया के लिएअसंभव होना चाहिए. हालांकि, संकेत[10] मिले हैं कि वीजमैन बाधा को पार किया जा सकता है। एक तरीका जिससे संभवतः इसका उल्लंघन हो सकता है वो यह है कि अगर किसी तरह इस इलाज का ग़लत अनुप्रयोग हो और यह वृषण तक फैल जाए तो जनन कोशाएं चिकित्सा के उद्देश्य के विपरीत इससे संक्रमित हो सकती हैं।
जीन चिकित्सा की समस्याओं में से कुछ हैं:
- जीन चिकित्सा की कम आयु की प्रकृति - इससे पहले कि जीन चिकित्सा किसी स्थिति का स्थायी इलाज कर सके, ये ज़रूरी है कि चिकित्सीय डी एन ए कार्यशील सटे और इस डी एन ए को धारण करने वाली कोशिकाएं भी लम्बी आयु की और स्थायी हों. उपचारात्मक डीएनए को जीनोम में जोड़ना और कई कोशिकाओं की तेजी से विभाजित होने की प्रकृति के चलते जीन चिकित्सा दीर्घकालिक फायदे नहीं दे पाती. रोगियों को जीन थेरेपी के कई दौर से गुजरना होगा.
- प्रतिरक्षा प्रतिक्रिया - जब भी मानव ऊतकों में कोई बाहरी वास्तु डाली जाती है तो प्रतिरक्षा प्रणाली वस्तु पर हमला करने के लिए ही विकसित हुआ है। ये एक खतरा हमेशा बना रहता है की प्रतिरक्षा प्रणाली प्रेरित होने से जीन चिकित्सा का असर कम हो जाएगा.इसके अलावा, बाहर से डाली गयी चीज़ के लिए प्रतिरक्षा प्रणाली की पहले हुई प्रतिवार्धित प्रतिक्रियाओं से उसी मरीज़ में जीन चिकित्सा का प्रयोग कठिन हो जाता है।
- वायरल वाहकों की समस्या - वायरस, ज्यादातर जीन चिकित्सा अध्ययनों में कई समस्याएँ पैदा करते हैं जैसे कि- विषैलापन, प्रतिरक्षा और उत्तेजित प्रतिक्रियाएं, जीन नियंत्रण तथा लक्ष्य मामले. इसके अलावा, हमेशा डर बना रहता है कि एक बार मरीज के अंदर वायरल वाहक चला गया तो वो कभी भी रोग का कारण बनने कि क्षमता रखता है।
- बहुजीनीय विकार - वो स्थिति या विकार जो किसी एक जीन में उत्परिवर्तन से पैदा होते हैं वे जीन चिकित्सा के सबसे अच्छे उम्मीदवार हैं। दुर्भाग्य से, सबसे अधिक होने वाली बीमारियों में से कुछ, जैसे हृदय रोग, उच्च रक्तचाप, अल्जाइमर रोग, गठिया, और मधुमेह, कई जीनों में बदलाव के संयुक्त प्रभाव के कारण होता है। इन जैअव बहुजीन या बहुघटकीय विकारों की चिकित्सा जीन चिकित्सा से विशेष रूप से कठिन है।
- एक ट्यूमर (इन्सर्शनल म्यूटाजेनेसिस) को शामिल करने की संभावना- यदि डीएनए जीनोम में गलत जगह पर जुड़ा है, उदाहरण के लिए एक ट्यूमर शमन करनेवाले जीन में तो यह एक ट्यूमर पैदा सकता है। एक्स-लिंक्ड गंभीर संयुक्त प्रतिरक्षा अभाव (एक्स-एस सी आई डी) से ग्रसित रोगियों के चिकित्सा प्रयासों के दौरान यह पाया गया जसमें हीमैटोपोयटिक स्टेम कोशाओं को एक रेट्रो वायरस का प्रयोग करके एक सुधारात्मक ट्रांस्जीन के साथ ट्रांसड्यूस किये गए और इससे 20 में से 3 मरीजों में टी सेल ल्यूकेमिया हो गया।[11]
लोगों की मृत्यु हुई जीन चिकित्सा के कारण मौतें हुयीं जिनमें शामिल है जेस गेल्सिंगर की मौत.[12]
लोकप्रिय संस्कृति में
संपादित करें- टी वी श्रृंखला डार्क एंगेल में जीन चिकित्सा को एक ऐसी प्रक्रिया के रूप में दिखाया गया जिसे मैंटीकोर में एक ट्रांसजेनिक्स और उसकी किराए की माँ पर प्रयोग किया गया और प्रोडिगी अंक में डॉक्टर तनाका ने जीन चिकित्सा के एक एकदम नए प्रयोग से एक कोकीन का नशा करने वाले एक नशेड़ी के अपरिपक्व जन्म वाले बच्चे जूड को एक प्रतिभाशाली लड़के में बदला.
- वीडियो खेल मेटल गियर सॉलिड में जीन चिकित्सा खेल की कहानी का एक मत्वपूर्ण हिस्सा है, जहाँ इसका प्रयोग दुश्मन सैनिकों की युद्ध क्षमताओं को बढ़ाने में किया गया है।
- विज्ञान एवं कल्पना पर आधारित श्रंखला स्टारगेट ऐटलांटिस में भी जीन चिकित्सा की महत्वपूर्ण भूमिका है। यहाँ इसका प्रयोग एक ऐसी निश्चित तरीके की तकनीक की तरह है जो टीम सदस्यों को जीन चिकित्सा के ज़रिये दिए जाते हैं।
- जेम्स बॉण्ड की फिल्म डाई ऐनदर डे की कहानी में भी जीन चिकित्सा की प्रमुख भूमिका है
- फ्रैंक मिलर की सिन सिटी से येलो बास्टर्ड भी स्पष्ट रूप से जीन थेरेपी का प्राप्तकर्ता था।
- डार्क नाइट स्ट्राइक्स अगेन में पहला रॉबिन यानि डिक ग्रेसन भी जोकर बनने से पहले कई सालों तक लेक्स लूथर द्वारा व्यापक जीन चिकित्सा का शिकार बनता है।
- वर्तमान समय में टीवी पर चल रहे विज्ञान और कल्पना पर आधारित कार्यक्रम रीजेनेसिस में भी जीन चिकित्सा की बड़ी भूमिका है जहाँ यह विभिन्न बीमारियों के इलाज में, खेल के प्रदर्शन को बढ़ाने और जैव तकनीक कंपनियों के लिए विशाल मुनाफे को इकट्ठा करने में काम आती है। (उदहारण के लिए, एक चरित्र द्वारा खुद पर जीन चिकित्सा का ऐसा प्रयोग किया जाता है जिसे पहचाना न जा सके और जिससे उसके प्रदर्शन को उम्दा बनाने में मदद मिलती है लेकिन कॉपीराइट उल्लंघन से बचने के लिए इस चिकित्सा को हानिरहित मूल रूप में संशोधित किया गया जिसकी वजह से एक घातक हृदय दोष का उत्पन्न हो जाता है।)
- आय ऍम लीजेंड फिल्म की कहानी में भी जीन चिकित्सा का महत्वपूर्ण आधार है।
- खेल बायोशोक में भी जीन चिकित्सा महत्वपूर्ण हिस्सा है जिसमें खेल सामग्री का मतलब है प्लास्मिड और[जीन] स्प्लाईसर है।
- माइकल क्रिश्तानकी अगली किताब नेक्स्ट भी एक ऐसी कहानी है जिसमें काल्पनिक जैव प्रौद्योगिकी कंपनियां शामिल हैं जो जीन चिकित्सा के प्रयोग करती हैं।
- टेलीविजन शो एलियास में, आण्विक जीन चिकित्सा मिएँ एक सफलता की खोज की जाती है जहाँ एक रोगी के शरीर को पूरी तरह किसी अन्य व्यक्ति के शरीर जैसा बना दिया जाता है। नायक सिडनी ब्रिस्टो का सबसे अच्छा दोस्त है जिसे चुपके से मार डाला गया और उसके जैसे "दुसरे" ने उसकी जगह ले ली.
इन्हें भी देखें
संपादित करेंसन्दर्भ
संपादित करें- ↑ Kahn J (2007-09-25). Wired (15.10): 3 http://www.wired.com/techbiz/people/magazine/15-10/ff_anderson?currentPage=3. मूल से 30 जून 2013 को पुरालेखित. अभिगमन तिथि 26 नवंबर 2009. गायब अथवा खाली
|title=(मदद) - ↑ [6]^मानव जीनोम परियोजना सूचना: जीन चिकित्सा
- ↑ Durai S, Mani M, Kandavelou K, Wu J, Porteus MH, Chandrasegaran S (2005). "Zinc finger nucleases: custom-designed molecular scissors for genome engineering of plant and mammalian cells". Nucleic Acids Res. 33 (18): 5978–90. PMID 16251401. डीओआइ:10.1093/nar/gki912. पी॰एम॰सी॰ 1270952.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Cavazzana-Calvo M, Thrasher A, Mavilio F (2004). "The future of gene therapy". Nature. 427 (6977): 779–81. PMID 14985734. डीओआइ:10.1038/427779a. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Morgan RA, Dudley ME, Wunderlich JR; एवं अन्य (2006). "Cancer regression in patients after transfer of genetically engineered lymphocytes". Science. 314 (5796): 126–9. PMID 16946036. डीओआइ:10.1126/science.1129003. पी॰एम॰सी॰ 2267026. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद); Explicit use of et al. in:|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Ott MG, Schmidt M, Schwarzwaelder K; एवं अन्य (2006). "Correction of X-linked chronic granulomatous disease by gene therapy, augmented by insertional activation of MDS1-EVI1, PRDM16 or SETBP1". Nat Med. 12 (4): 401–9. PMID 16582916. डीओआइ:10.1038/nm1393. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद); Explicit use of et al. in:|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Brown BD, Venneri MA, Zingale A, Sergi Sergi L, Naldini L (2006). "Endogenous microRNA regulation suppresses transgene expression in hematopoietic lineages and enables stable gene transfer". Nat Med. 12 (5): 585–91. PMID 16633348. डीओआइ:10.1038/nm1398. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ [19]^बीबीसी समाचार | स्वास्थ्य | जीन थेरेपी का उपयोग सबसे पहले कमज़ोर दृष्टि के लिए
- ↑ Maguire AM, Simonelli F, Pierce EA; एवं अन्य (2008). "Safety and efficacy of gene transfer for Leber's congenital amaurosis". N Engl J Med. 358 (21): 2240–8. PMID 18441370. डीओआइ:10.1056/NEJMoa0802315. मूल से 2 अगस्त 2009 को पुरालेखित. अभिगमन तिथि 26 नवंबर 2009. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद); Explicit use of et al. in:|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Korthof G. "The implications of Steele's soma-to-germline feedback for human gene therapy".
- ↑ Woods NB, Bottero V, Schmidt M, von Kalle C, Verma IM (2006). "Gene therapy: therapeutic gene causing lymphoma". Nature. 440 (7088): 1123. PMID 16641981. डीओआइ:10.1038/4401123a. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
Thrasher AJ, Gaspar HB, Baum C; एवं अन्य (2006). "Gene therapy: X-SCID transgene leukaemogenicity". Nature. 443 (7109): E5–6, discussion E6–7. PMID 16988659. डीओआइ:10.1038/nature05219. नामालूम प्राचल|month=की उपेक्षा की गयी (मदद); Explicit use of et al. in:|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ [27]^http://www.ornl.gov/sci/techresources/Human_Genome/medicine/genetherapy.shtml#status
- टिन्कोव, एस., बेकेरेदीजान, आर., विंटर, जी., कोस्टर, सी., पोलीप्लेक्स-संयुग्मित सूक्ष्मबुद्बुद के लिए परिष्कृत पराध्वनि लक्षित जीन चिकित्सा, 2008 ए ए पी एस वार्षिक सम्मलेन एवं प्रदर्शन, 16-20 नवम्बर जॉर्जिया विश्व कांग्रेस केंद्र, अटलांटा, जी ए, संयुक्त राज्य अमरीका, (http://www.aapsj.org/abstracts/AM_2008/AAPS2008-000838.PDF Archived 2012-07-07 at the वेबैक मशीन)
- Gardlík R, Pálffy R, Hodosy J, Lukács J, Turna J, Celec P (2005). "Vectors and delivery systems in gene therapy". Med Sci Monit. 11 (4): RA110–21. PMID 15795707. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- Staff (नवम्बर 18, 2005). "Gene Therapy" (FAQ). Human Genome Project Information. Oak Ridge National Laboratory. अभिगमन तिथि 2006-05-28.
- Salmons B, Günzburg WH (1993). "Targeting of retroviral vectors for gene therapy". Hum Gene Ther. 4 (2): 129–41. PMID 8494923. डीओआइ:10.1089/hum.1993.4.2-129. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)
- Baum C, Düllmann J, Li Z; एवं अन्य (2003). "Side effects of retroviral gene transfer into hematopoietic stem cells". Blood. 101 (6): 2099–114. PMID 12511419. डीओआइ:10.1182/blood-2002-07-2314. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद); Explicit use of et al. in:|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- Horn PA, Morris JC, Neff T, Kiem HP (2004). "Stem cell gene transfer—efficacy and safety in large animal studies". Mol. Ther. 10 (3): 417–31. PMID 15336643. डीओआइ:10.1016/j.ymthe.2004.05.017. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- Wang, Hongjie; Dmitry M. Shayakhmetov, Tobias Leege, Michael Harkey, Qiliang Li, Thalia Papayannopoulou, George Stamatoyannopolous, and André Lieber (2005). "A capsid-modified helper-dependent adenovirus vector containing the beta-globin locus control region displays a nonrandom integration pattern and allows stable, erythroid-specific gene expression". Journal of Virology. 79 (17): 10999–1013. PMID 16103151. डीओआइ:10.1128/JVI.79.17.10999-11013.2005. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
बाह्य सम्बन्ध
संपादित करें| विकिपुस्तक पर Genes, Technology and Policy से सम्बन्धित एक किताब है। |
- जीन चिकित्सा: एक आण्विक पट्टी है? Archived 2006-04-27 at the वेबैक मशीन यूटा विश्वविद्यालय का आनुवंशिक विज्ञान अध्ययन केंद्र
- जीन और कोशिका चिकित्सा की अमरीकी समिति Archived 2009-11-29 at the वेबैक मशीन
- जीन चिकित्सा की यूरोपीय समिति Archived 2009-10-26 at the वेबैक मशीन
- 2003 जीन थेरेपी से संबंधित समाचार
- कैम्ब्रिज में शोध समूह, सफल जीन चिकित्सा के लिए ब्रिटेन मौजूदा बाधाओं पर काबू पाने का काम कर रही है Archived 2006-09-23 at the वेबैक मशीन
- आनुवंशिक विज्ञान का उत्तरदायी परिषद
- लंडन विश्वविद्यालय में आण्विक और जीन चिकित्सा
- जीन चिकित्सा और नैदानिक परीक्षणों पर बनी एक फाइल Archived 2010-07-29 at the वेबैक मशीन
- जीन चिकित्सा नेट जीन चिकित्सा से सम्बंधित सभी जानकारियों का केंद्र बिंदु है
- cancer-genetherapy.com Archived 2013-05-21 at the वेबैक मशीन साइट, कैंसर जीन चिकित्सा पर ध्यान केन्द्रित कर रहा है
- जीन चिकित्सा की समीक्षा