समावयवता
रासायनिक यौगिकों का जब सूक्ष्मता से अध्ययन किया गया, तब देखा गया कि यौगिकों के गुण उनके संगठन पर निर्भर करते हैं। जिन यौगिकों के गुण एक से होते हैं उनके संगठन भी एक से ही होते हैं और जिनके गुण भिन्न होते हैं उनके संगठन भी भिन्न होते हैं। बाद में पाया गया कि कुछ ऐसे यौगिक भी हैं जिनके संगठन, अणुभार तथा अणु-अवयव एक होते हुए भी, उनके गुणों में विभिन्नता है। ऐसी विशिष्टता वाले यौगिकों को समावयवी (Isomer, Isomeride) संज्ञा दी गई और इस गुण का नाम समावयवता (=सम + अवयवता / Isomerism) रखा गया।

- उदाहरण C3H4
हाइड्रोकार्बन के तीन समावयव हैं। नीचे देखेंगे कि यह 'संरचनात्मक समावयवता' का उदाहरण है।

|
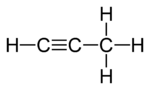
|

|
| I
प्रोपेडाइ-ईन (Propadiene) |
II
प्रोपीन (Propyne) |
III
साइक्लोप्रोपीन (Cyclopropene) |
प्रकार
संपादित करेंसमावयवता प्रधानतया दो प्रकार की होती है: एक को संरचनात्मक समावयवता (Structural isomerism) और दूसरे को त्रिविम समावयवता (Stereo-isomerism) कहते हैं।
संरचनात्मक समावयवता
दो या दो से अधिक यौगिक जिनके अणुसूत्र समान् हो परन्तु उनकी संरचनासूत्र भिन्न हो,Structural Isomerism कहलाता हैं
यदि दो यौगिकों के अणुसूत्र और अणुसूत्र एक ही हों, पर उनके गुणों में विभिन्नता हो, तो इसका यही कारण हो सकता है कि उनके अणु की संरचनाओं में विभिन्नता है। ऐसे दो सरलतम यौगिक एथिल ऐल्कोहॉल और डाइमेथिल ईथर हैं, जिनका अणुभार तथा अणुसूत्र, C2 H6 O, एक ही है, पर इनके संरचनासूत्र भिन्न हैं।
एथिल ऐल्कोहॉल में दो कार्बन परमाणु परस्पर संबद्ध होकर, हाइड्रॉक्सील समूह से संयुक्त हैं जबकि डाइमेथिल ईथर में दो कार्बन परमाणु ऑक्सीजन परमाणु द्वारा एक दूसरे से संबद्ध हैं। दोनों के गुणों में बहुत भिन्नता है। उनकी क्रिया से विभिन्नता स्पष्ट हो जाती है। एथिल ऐल्कोहॉल पर HI की क्रिया से एथिल आयोडाइड, C2 H5 I, बनता है, जबकि डाइमेथिल ईथर से मेथिल आयोडाइड, (CH3I) बनता है। अन्य अभिकर्मकों के साथ भी ऐसी भिन्न क्रियाएँ होती हैं।
| C2H6O के दो समावयव : इथेनॉल तथा डाइमेथिल ईथर | |
यदि ऐसे यौगिकों की समावयवता ऐसी समावयवता एक ही श्रेणी के यौगिकों के बीच हो, तो ऐसी समावयवता को मध्यावयवता (Metamerism) कहते हैं। इसका उदाहरण डाइएथिल ईथर (C2H5OC2H5) और मेथिल प्रोपिल ईथर (CH3 OC3 H7) है। पैराफिन श्रेणी के हाइड्रोकार्बनों में ऐसे अनेक उदाहरण मिलते हैं। पेन्टेन (C5H12) के तीन समावयव होते हैं : नार्मल पेंटेन, आइसो-पेंटेन और नियोपेंटेन। ऐसी समावयवता को शृंखला समावयवता (Chain isomerism) भी कहते हैं, क्योंकि यहाँ शृंखला में ही अंतर होने के कारण विभिन्नता है।
इसी समावयवता से मिलती-जुलती एक दूसरी समावयवता है, जिसे स्थान-समावयवता (Position isomerism) कहते हैं, इसका सरलतम उदाहरण प्रोपिल क्लोराइड (CH3 CH2 CH2 Cl) और आइसोप्रोपिल क्लोराइड (CH3 CHCl CH3) है, जिनमें अंतर केवल क्लोरीन परमाणु के स्थान से संबंध रखता है। एक में क्लोरीन अन्त के एक कार्बन परमाणु से संबद्ध है और दूसरे में क्लोरीन मध्य के कार्बन से संबद्ध है। इसी प्रकार की समावयवता डाइक्लोरोबेंज़ोन में भी है
त्रिविम समावयवता
संपादित करेंत्रिविम रसायन भी देखें।
यौगिकों के अणुभार और संरचना के एक रहते हुए भी परमाणुओं के विभिन्न दिशाओं में व्यवस्थित रहने के कारण यौगिक में समावयवता हो सकती है। ऐसी समावयवता को त्रिविम समावयवता (Stereo-isomerism) कहते हैं। त्रिविम समावयवता दो प्रकार की होती है :
- (1) प्रकाशिक समावयवता (Optical isomerism), और
- (2) ज्यामितीय समावयवता (Geometrical Isomerism)
प्रकाशिक समावयवता
संपादित करेंलैक्टिक अम्ल के अध्ययन में देखा गया है कि लैक्टिक अम्ल तीन प्रकार का होता है, दो प्रकाशतः सक्रिय और एक प्रकाशतः निष्क्रिय। इसी प्रकार टार्टेरिक अम्ल भी चार प्रकार का होता है, दो प्रकाशतः सक्रिय और दो प्रकाशतः निष्क्रिय। इनकी उपस्थिति की संतोषप्रद व्याख्या उस समय तक ज्ञात सिद्धांतों से नहीं हो सकती थी। इनकी व्याख्या के लिए जो सिद्धांत प्रतिपादित हुआ है, उसे त्रिविम समावयवता का सिद्धान्त कहते हैं और इससे रसायन की एक नई शाखा की नींव पड़ी है, जिसे त्रिविम रसायन कहते हैं।
इस नए सिद्धान्त के प्रतिपादक डच रसायनज्ञ, वांत हॉफ़ (Van't Hoff) और दूसरे फ्रांसीसी रसायनज्ञ, ला बेल (La Bel), थे। दोनों ने स्वतंत्र रूप से प्रायः एक ही समय 1774 ईसवी में इस सिद्धान्त का प्रतिपादन किया और दोनों रसायनज्ञों के मूल सिद्धांत प्रायः एक ही हैं, यद्यपि विस्तार में कुछ अंतर है। इस सिद्धान्तानुसार चतुष्फलकी के केंद्र में कार्बन परमाणु स्थित रहता है और इसकी चारों संयोजकताएँ चतुष्फलक के चारों छोरों की ओर अभिमुख होती हैं। यदि इन चारों संयोजकताओं के साथ चार विभिन्न समूह संबंधित हों, तो ये ऐसी अवस्थाएँ उपस्थित करते हैं जिनकी व्यवस्था दो प्रकार से हो सकती है। यदि चारों समूह H, OH, COOH और CH3, हों, जैसे लैक्टिक अम्ल में होते हैं, तो उनकी व्यवस्था, दक्षिणावर्त (H, OH, COOH, CH3) और दूसरे में वामावर्त (H, CH3, COOH, OH) हो सकती है। ये दोनों रूप वैसे ही हैं जैसे कोई एक वस्तु और उसका प्रतिबिंब होता है। एक व्यवस्था प्रकाश को एक ओर जितना घुमाती है, दूसरी व्यवस्था प्रकाश के विपरीत दिशा में उतना ही घुमाएगी। इस प्रकार ऐसे यौगिक के दो प्रकाशीय रूप हो सकते हैं। यदि ये दोनों रूप सममात्रा में किसी विलयन में विद्यमान हों, तो ऐसा विलयन प्रकाशत: निष्क्रिय होगा। वस्तुतः निष्क्रिय लैक्टिक आम्ल ऐसा ही मिश्रण है, क्योंकि fयह अनेक विधियों से दो सक्रिय लैक्टिक अम्लों में विभेदित किया जा सकता है।
चतुष्फलक के मध्य में स्थित कार्बन परमाणु को असममित (asymmetric) कार्बन परमाणु कहते हैं और प्रकाश सक्रियता के लिए एक या एक से अधिक असमित कार्बन परमाणु का होना अनिवार्य है। इसके अभाव में प्रकाशीय सक्रियता संभव नहीं है। अनुभव और प्रयोगों से यह बात बिल्कुल ठीक प्रमाणित होती है। टार्टेंरिक अम्ल में दो असममित कार्बन परमाणु होते हैं। टार्टेरिक अम्ल की विशेषता यह है कि इसके दोनों असममित कार्बन के साथ एक ही प्रकार के समूह संबद्ध हैं। यदि दोनों असममित कार्बन के साथ ऐसे समूह संबद्ध हों जो दक्षिणवर्त हैं, तो वह यौगिक दक्षिणावर्त होगा तथा यदि दोनों असममित कार्बनों के साथ ऐसे समूह संबद्ध हों जो वामावर्त हैं, तो वह यौगिक वामावर्त होगा और यदि दोनों असममित कार्बन के साथ एक दक्षिणावर्त और दूसरा वामावर्त समूह संबद्ध हो, तो एक के प्रभाव को दूसरा निष्क्रिय कर देगा, जिससे वह यौगिक प्रकाशतः निष्क्रिय होगा। पर यह यौगिक ऐसा निष्क्रिय होगा कि उसे सक्रिय नहीं बनाया जा सकता। ऐसा ही टार्टेरिक अम्ल का रूप मेज़ो-टार्टेरिक अम्ल है। चौथा टार्टेरिक अम्ल ऐसा हो सकता है जिसमें दक्षिणावर्त और वामावर्त टार्टेरिक अम्ल की सममात्रा विद्यमान हो। ऐसा यौगिक रेसिमिक अम्ल है। यह भी प्रकाशतः निष्क्रिय होता है, पर सक्रिय अवयवों में विभेदित किया जा सकता है। इस प्रकार इस सिद्धांत से चार प्रकार के टार्टेरिक अम्ल की उपस्थिति की व्याख्या सरलता से हो जाती है।
इस प्रकार की त्रिविम समावयवता केवल कार्बनिक यौगिकों में ही नहीं पाई गई हैं, वरन् नाइट्रोजन, फॉस्फोरस, आर्सेनिक, गंधक और सिलिकन आदि के यौगिकों में भी पाई गई है।
ज्यामितीय समावयवता
संपादित करेंज्यामितीय समावयवता में सामान्यतः प्रकाश सक्रियता नहीं होती। यह समावयवता उन्हीं यौगिकों में पाई जाती है जिनमें दो कार्बन परमाणु युग्म बंध से बँधे होते हैं।
सिस-ट्रैंस समावयवता
संपादित करेंयदि ऐसे यौगिकों के दोनों कार्बन परमाणुओं से एक से अधिक समूह संबद्ध हों, तो उससे निम्नलिखित प्रकार के दो यौगिक बन सकते हैं। एक, जिसमें दोनों समूह एक ही पक्ष में हैं और दूसरा, जिसमें दोनों समूह प्रतिकूल पक्ष में हैं। पहले यौगिकों को सिस (Cis) और दूसरे को ट्रैंस (Trans) कहते हैं। ऐसे यौगिकों में युग्म बंध (बहु बंध - द्विक-बन्ध या त्रि-बन्ध) के कारण अणु में दृढ़ता होती है, जिससे उसका मुक्त घूर्णन अवरुद्ध हो जाता है। ऐसे समावयव यौगिकों के सरलतम उदाहरण मलेइक अम्ल और फ्यूमेरिक अम्ल हैं। मलेइक अम्ल में दोनों कार्बोक्सील समूह एक ही पक्ष में होते हैं और फ्यूमेरिक अम्ल में दोनों कार्बोक्सील समूह प्रतिकूल पक्ष में। इसकी पुष्टि इस बात से होती है कि मलेइक अम्ल अति शीघ्र ऐनहाइड्राइड बनाता है, जो कार्बोक्सील समूह की निकटता को प्रदर्शित करता है और फ्यूमेरिक अम्ल इतना जल्द ऐनहाइड्राइड नहीं बनाता, जो कार्बोक्सील समूह की दूरी को प्रदर्शित करता है। यदि ऐनहाइड्राइड कठिनता से बनता भी है, तो वह मलेइक ऐनहाइड्राइड ही होता है।
| trans-1,2-dichlorocyclohexane | cis-1,2-dichlorocyclohexane |
ऐसी समावयवता के लिए यह आवश्यक नहीं कि एक कार्बन परमाणु दूसरे कार्बन परमाणु के साथ ही संयुक्त हो। कार्बन यदि नाइट्रोजन के साथ संयुक्त हो, तो भी ऐसे समावयवी बनते हैं। इसके उदाहरण अनेक ऑक्सीम हैं, जो कीटोन पर हाइड्राक्सिल ऐमीन की क्रिया से बनते हैं।
चल समावयवता
संपादित करेंएक दूसरे प्रकार की समावयवता को चल समावयवता, या चलावयवता (Dynamic Isomerism या Tautomerism) कहते हैं। यह यौगिकों में किसी तत्व के, विशेषतः हाइड्रोजन के, एक स्थान से दूसरे स्थान पर स्थानान्तरण से होती है। इसका अच्छा उदाहरण कीटो-इनोल-समावयवता (Keto-enol Isomerism) है, जिसमें एक ही पदार्थ कभी कीटोन सा व्यवहार करता है और कभी इनोल सा। यहाँ एक समावयवी का दूसरे समावयवी में परिवर्तन केवल विलयाकों में घुलाने से, अथवा किसी उत्प्रेरक की उपस्थिति से ही सम्पन्न होता है। ऐसी ही समावयवता के कारण शर्कराओं का परिवर्ती घूर्णन होता है।
| कीटो-इनोल-समावयवता |
