हीमोग्लोबिन
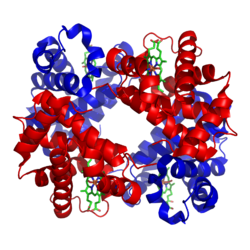
रुधिरवर्णिका या हीमोग्लोबिन (वर्तनी में हेमोग्लोबिन और संक्षिप्त में एचबी या एचजीबी) पृष्ठवंशियों[1] की लाल रक्त कोशिकाओं और कुछ अपृष्ठवंशियों के ऊतकों में पाया जाने वाला लौह-युक्त आक्सीजन का परिवहन करने वाला धातुप्रोटीन है. रक्त में मौजूद हीमोग्लोबिन फेफड़ों या गिलों से शरीर के शेष भाग (अर्थात् ऊतक) को ऑक्सीजन का परिवहन करता है, जहां वह कोशिकाओं के प्रयोग के लिये आक्सीजन को मुक्त कर देता है।
स्तनपायियों में लाल रक्त कोशिकाओं के शुष्क भाग का करीब 97% और कुल भाग (पानी सहित) का लगभग 35% प्रोटीन से बना होता है। [उद्धरण चाहिए]
हीमोग्लोबिन की आक्सीजन को बांधने की क्षमता हीमोग्लोबिन के प्रति ग्राम के लिये 1.36 और 1.37 मिली O2 के बीच होती है, जो कुल रक्त आक्सीजन क्षमता को सत्तर गुना बढ़ा देती है।[2]
हीमोग्लोबिन लाल रक्त कोशिकाओं और उनको उत्पन्न करने वाली प्रोजेनिटर रेखाओं के बाहर भी पाई जाती है. हीमोग्लोबिन युक्त अन्य कोशिकाओं में सबस्टैंशिया नाइग्रा के ए९ डोपमिनर्जिक न्यूरान, मैक्रोफैज, अल्वियोलार कोशिकाएं और गुर्दों की मेसैंजियल कोशिकाएं शामिल हैं. इन ऊतकों में हीमोग्लोबिन की भूमिका आक्सीजन के परिवहन की जगह एंटीआक्सीडैंट और लौह चयापचय के नियंत्रक के रूप में होती है।[3]
शोध का इतिहास
संपादित करेंआक्सीजन-वाहक प्रोटीन हीमोग्लोबिन की खोज हूनफील्ड द्वारा 1840 में की गई थी.[4] 1851 में[5] ओटो फंक ने लेखों की एक श्रृंखला का प्रकाशन किया जिसमें उन्होंने लाल रक्त कोशिकाओं को शुद्ध जल, अल्कोहल या ईथर जैसे घोलकों की सहायता से पतला करने के बाद प्राप्त प्रोटीन के घोल से घोलक का धीमा वाष्पीकरण करके हीमोग्लोबिन के स्फटिकों को उगाने के बारे में बताया.[6]
हीमोग्लोबिन के प्रतिवर्ती आक्सीकरण के बारे में फेलिक्स हाप-सीलर द्वारा कुछ और वर्षों के बाद बताया गया.[7] 1959 में मैक्स पेरूट्ज़ ने एक्सरे क्रिस्टेलोग्राफी द्वारा हीमोग्लोबिन की आण्विक रचना को निश्चित किया.[8][9] इस उपलब्धि के लिये उन्हें जॉन केन्ड्रू के साथ 1962 का रसायनशास्त्र में नोबल पुरस्कार दिया गया.
रक्त में हीमोग्लोबिन की भूमिका का विवरण फिजियोलाजिस्ट क्लाडे बर्नार्ड द्वारा दिया गया. हीमोग्लोबिन नाम हीम और ग्लोबिन शब्दों की संधि से प्राप्त किया गया है, जो यह बताता है कि हीमोग्लोबिन की प्रत्येक उपइकाई हीम (हेम) समूह से जड़ा एक ग्लोबुलार प्रोटीन है. हर हीम समूह में एक लौह परमाणु होता है, जो आयन-उत्प्रेरित बलों के जरिये एक आक्सीजन अणु को बांध सकता है. स्तनपायियों के सबसे आम हीमोग्लोबिन में ऐसी चार उपइकाईयां होती हैं.
आनुवंशिकी
संपादित करेंहीमोग्लोबिन में अधिकतर प्रोटीन (ग्लोबिन श्रृंखलाएं) होता है और ये प्रोटीन अमाइनो एसिडों की श्रृंखलाओं से बने होते हैं. ये श्रृंखलाएं रैखिक रूप में होती हैं, जैसे किसी लिखे गए वाक्य में अक्षर होते हैं या माला में मोती लगे होते हैं. सभी प्रोटीनों में अमाइनों एसिडों की प्रोटीन श्रृंखला में अमाइनो एसिडों के प्रकारों में विभिन्नता उस प्रोटीन के रसायनिक गुणों और कार्य को निश्चित करती है. यही बात हीमोग्लोबिन पर भी लागू होती है, जिसमें अमाइनो एसिडों की श्रृंखला आक्सीजन के प्रति प्रोटीन के आकर्षण जैसे महत्वपूर्ण कार्यों को प्रभावित कर सकती है.
हीमोग्लोबिनों में ग्लोबिन प्रोटीनों की अमाइनो एसिड श्रृंखलाएं विभिन्न जातियों में भिन्न होती है, हालांकि भिन्नताएं जातियों के बीच विकास की दूरी के साथ बढ़ती हैं. उदाहरण के लिये मानव और चिम्पान्ज़ियों में सबसे आम हीमोग्लोबिन श्रृंखलाएं समान होती हैं, जबकि यह समान श्रृंखला गुरिल्ला की सबसे आम अमाइनो एसिड श्रृंखला से अल्फा और बीटा ग्लोबिन प्रोटीन श्रृंखलाओं में केवल एक अमाइनो एसिड द्वारा भिन्न होती है. ये भिन्नताएं कम संबंध वाली जातियों में अधिक होती हैं. हीमोग्लोबिन के अलावा अन्य प्रोटीनों की तरह जातियों के बीच डीएनए श्रृंखलाओं में भिन्नताएं उनके द्वारा कोड की गई अमाइनो एसिड श्रृंखलाओं की भिन्नताओं से अधिक होती हैं, क्यौंकि विभिन्न डीएनए श्रृंखलाएं एक ही अमाइनो एसिड की ओर इंगित कर सकती हैं.
किसी एक जाति में भी, हीमोग्लोबिन के विभिन्न प्रकार हमेशा मौजूद होते हैं, हालांकि हर जाति में कोई एक श्रृंखला सामान्यतः सबसे अधिक पाई जाती है. हीमोग्लोबिन प्रोटीन की जीनों की विकृतियों के कारण हीमोग्लोबिन के विभिन्नतायुक्त प्रकार उत्पन्न होते हैं.[10][11] इनमें से अनेक विकृत प्रकारों के कारण कोई रोग नहीं होता है. लेकिन कुछ विकृत हीमोग्लोबिनों के कारण हीमोग्लोबिनोपैथीज़ नामक आनुवंशिक रोगों के एक समूह की उत्पत्ति होती है. सिकल सैल रोग सबसे मशहूर हीमोग्लोबिनोपैथी है, जो मनुष्य का पहला रोग है, जिसकी प्रक्रिया आण्विक स्तर पर समझी गई है. एक (अधिकतर) अन्य रोगों के समूह, थैलेसीमिया में, ग्लोबिन जीन नियंत्रण की समस्याओं और विकृतियों के कारण सामान्य या कभी-कभी असामान्य हीमोग्लोबिनों का कम मात्रा में उत्पादन होता है. इन सभी रोगों में रक्ताल्पता होती है.[12]
अन्य प्रोटीनों की तरह, हीमोग्लोबिन के अमाइनो एसिडों की श्रृंखलाएं अनुकूली हो सकती हैं. उदहारण के लिए, हाल के अध्ययनों में दर्शाया गया है कि पर्वतों में रहने वाले हरिण मूषक कैसे उनके भिन्न जीन प्रकारों की मदद से ऊंचाईयों पर पाई जाने वाली पतली वाय़ु में जीवित रहते हैं. नेब्रास्का-लिंकन विश्वविद्यालय के एक शोधकर्ता ने चार भिन्न जीनों में विकृतियां पाईं जिन्हें निचले इलाकों और पर्वतों में रहने वाले हरिण मूषकों के बीच पाई जाने वाली भिन्नताओं के लिये जिम्मेदार समझा जाता है. पहाड़ों और निचले इलाकों से पकड़े गए जंगली मूषकों की जांच करने पर पाया गया कि दोनों नस्लों की जीनें एक समान थीं, सिवाय उनके जो उनके हीमोग्लोबिन की आक्सीजन-वाहक क्षमता को नियंत्रित करती हैं. पहाड़ी मूषक की जीनीय भिन्नता उसे आक्सीजन का अधिक बेहतर प्रयोग करने की क्षमता प्रदान करती है, क्योंकि पर्वतों जैसे ऊंचे स्थानों पर वह कम मात्रा में उपलब्ध होती है.[13] प्राचीन हाथियों के हीमोग्लोबिन की विकृतियों के कारण कम तापमान के इलाकों में भी आक्सीजन की आपूर्ति संभव होती थी, जिससे वे प्लीस्टोसीन के दौरान अधिक ऊंचाईयों पर आसानी से रह सकते थे.[14]
संश्लेषण
संपादित करेंहीमोग्लोबिन का संश्लेषण एक जटिल सोपान श्रृंखला में होता है. हीम भाग का संश्लेषण अपरिपक्व लाल रक्त कोशिकाओं के माइटोकांड्रिया और साइटोसॉल में विभिन्न कदमों में होता है, जबकि ग्लोबिन प्रोटीन भाग साइटोसॉल में रिबोसोमों द्वारा संश्लेषित होते हैं.[15] अस्थि-मज्जा में हीमोग्लोबिन का उत्पादन प्रोएरिथ्रोब्लास्ट से रेटिकुलोसाइट अवस्था तक उसके प्रारंभिक विकास के संपूर्ण काल में कोशिका में होता है. इस समय स्तनपायियों की लाल रक्त कोशिकाओं का केन्द्रक गायब हो जाता है, लेकिन पक्षियों और कई अन्य जातियों में ऐसा नहीं होता. स्तनपायियों में केन्द्रक के न होने पर भी, बचा हुआ रिबोसोमल आरएनए हीमोग्लोबिन का तब तक उत्पादन करता है, जब तक कि रक्त प्रवाह में प्रवेश करने के बाद रेटिकुलोसाइट का आरएनए समाप्त नहीं हो जाता.(दरअसल इसी हीमोग्लोबिन-संश्लेषक आरएनए के कारण रेटिकुलोसाइट को उसका जालीदार रूप और नाम मिला है).
रचना
संपादित करेंहीमोग्लोबिन प्रोटीनों की तृतीयक और चतुर्थक रचनाओं, दोनों के गुण प्रदर्शित करता है.[16] हीमोग्लोबिन के अधिकांश अमाइनो एसिड अल्फा होलिक्सों का निर्माण करते हैं जो छोटे अहेलिकीय खंडों से जुड़े होते हैं. इस प्रोटीन के भीतर हाइड्रोजन बाँड हेलिकीय सेक्शनों को स्थिर करते हैं, जिससे अणु के भीतर आकर्षण उत्पन्न हो जाते हैं और प्रत्येक पालिपेप्टाइड श्रृंखला एक विशेष आकार में मुड़ जाती है.[17] हीमोग्लोबिन की क्वाटरनरी रचना टैट्राहैड्राल व्यवस्था में स्थित उसकी चार उपइकाईयों के कारण बनती है.[16]
अधिकांश मनुष्यों में हीमोग्लोबिन अणु चार ग्लोबुलार प्रोटीन उपइकाईयों का एक समूह होता है. प्रत्येक उपइकाई एक गैर-प्रोटीन हीम समूह से कस कर जुड़ी एक प्रोटीन श्रृंखला से बनी होती है. प्रत्येक प्रोटीन श्रृंखला एक ग्लोबिन फोल्ड व्यवस्था में आपस में जुड़े अल्फा-हेलिक्स रचनात्मक खंडों के सेट के रूप में व्यवस्थित होती है, क्यौंकि मयोग्लोबिन जैसे अन्य हीम/ग्लोबिन प्रोटीनों में इसी फोल्डिंग मोटिफ जैसी व्यवस्था होती है.[18][19] इस फोल्डिंग पैटर्न में एक स्थान होता है, जो हीम समूह को मजबूती से पकड़े रखता है.
हीम समूह में एक लौह आयन होता है जो एक हीटरोसाइक्लिक रिंग, जिसे पॉरफाइरिन कहते हैं, में रहता है. इस पॉरफाइरिन रिंग में चार पाइरोल अणु होते हैं, जो केन्द्र में स्थित लौह आयन से चक्र के रूप में जुड़े होते हैं.[20] लौह आयन, जो आक्सीजन बंधन का स्थानहोता है, रिंग के केन्द्र में समान तल में रहने वाले चार नाइट्रोजनों के साथ मिल कर काम करता है. लौह पॉरफाइरिन रिंग के नीचे स्थित एफ8 हिस्टिडीन रेजिड्यू की इमिडाजोल रिंग के जरिये ग्लोबुलार प्रोटीन से मजबूती से जुड़ा होता है. एक छटा स्थान एक कोआर्डीनेट कोवैलैंट बांड के द्वारा आक्सीजन को प्रतिवर्ती रूप से बांध सकता है और इस तरह छह लाइगैंडों के आक्टाहेड्राल समूह को पूरा करता है.[21] आक्सीजन एक एंड-आन बेंट ज्यामिति में बंधती है, जहां आक्सीजन परमाणु लौह से बंधित होता है और दूसरा एक कोण पर बाहर निकला होता है. जब आक्सीजन बंधी नहीं होती है, तब एक कमजोर बंधन वाला जल अणु उस स्थान को भर देता है, जिससे एक विकृत आक्टाहेड्रान बनता है.
यद्यपि कार्बन डाई आक्साइड का परिवहन हीमोग्लोबिन द्वारा होता है, यह लौह-बंधक स्थानों के लिये आक्सीजन से स्पर्धा नहीं करता, बल्कि वास्तव में रचना की प्रोटीन श्रृंखलाओं से जुड़ा होता है.
लौह आयन Fe2+ या Fe3+ दशा में हो सकता है, लेकिन फेरिहीमोग्लोबिन (मेटहीमोग्लोबिन) (Fe3+) आक्सीजन को नहीं बांध सकता है.[22] बाइंडिंग में आक्सीजन अस्थाई और प्रतिवर्ती रूप से (Fe2+) को (Fe3+) में आक्सीकृत कर देती है, जबकि आक्सीजन अस्थाई रूप से सुपरआक्साइड में परिवर्तित हो जाती है. इस तरह आक्सीजन को बांधने के लिये लोहे को आक्सीकरण दशा में रहना पड़ता है. यदि Fe3+ से संबंधित सुपरआक्साइड आयन का प्रोटोनोकरण कर दिया जाए तो हीमोग्लोबिन लौह आक्सीकृत रहता है और आक्सीजन को बांधने में असमर्थ होता है. ऐसी स्थिति में एंजाइम मेटहीमोग्लोबिन रिडक्टेज़ लौह केंद्र को घटा कर अंततः मेटहीमोग्लोबिन को पुनर्सक्रिय कर सकता है.
वयस्क मनुष्यों में सबसे आम हीमोग्लोबिन प्रकार हीमोग्लोबिन ए नामक एक टैट्रामर (चार उपइकाई प्रोटीन युक्त) होता है, जिसमें नान-कोवैलेंट बंधन वाले दो अल्फा और दो बीटा उपइकाईयां होती हैं जो क्रमशः 141 और 146 अमाइनो एसिडों से बनी होती हैं. इसे α2β2 से इंगित किया जाता है. ये उपइकाईयां रचनात्मक रूप से समान और लगभग एक ही आकार की होती हैं. प्रत्येक उपइकाई का अणु भार करीब 17000 डाल्टन होता है और टेट्रामर का कुल अणुभार करीब 68000 डाल्टन (64,458 ग्रा/मॉल) होता है.[23] इस तरह 1 ग्रा/डीएल = 0.1551 मिलीमॉल/ली. हीमोग्लोबिन ए हीमोग्लोबिन अणुओं में सबसे अधिक शोधित अणु है.
मानव शिशुओं में हीमोग्लोबिन अणु 2 अल्फा और 2 गामा श्रृंखलाओं से बना होता है. जैसे जैसे शिशु बढ़ता है गामा श्रृंखलाएं धीरे-धीरे बीटा श्रृंखलाओं द्वारा विस्थापित हो जाती हैं.[24]
ये चार पॉलिपेप्टाइड श्रृंखलाएं आपस में लवण सेतुओं, हाइड्रोजन बांडों और हाइड्रोफोबिक अंतर्क्रियाओं से बंधी होती हैं. अल्फा और बीटा श्रृंखलाओं के बीच दो तरह के संपर्क होते हैं - α1β1 और α1β2.
मोटे तौर पर, हीमोग्लोबिन को आक्सीजन अणुओं से संतृप्त (आक्सीहीमोग्लोबिन) या असंतृप्त (डीआक्सीहीमोग्लोबिन) किया जा सकता है.[25] आक्सीहीमोग्लोबिन की उत्पत्ति शरीरक्रियात्मक श्वसन के समय होती है जब लाल रक्त कोशिकाओं में प्रोटीन हीमोग्लोबिन के हीम भाग का आक्सीजन से बंधन होता है. यह प्रक्रिया फेफड़ों में वायुकोष्ठों के पास स्थित फुफ्फुसीय केशिकाओं में होती है. इसके बाद आक्सीजन रक्त प्रवाह द्वारा कोशिकाओं तक पहुंचती है जहां उसका प्रयोग वातापेक्षी ग्लाइकोलाइसिस के जलअपघटन के लिये और एटीपी के निर्माण में आक्सीकरणीय फास्फारिलीकरण के लिये किया जाता है. लेकिन रक्त के पीएच की कमी को रोकने में यह मददगार नहीं होती है. शवसन क्रिया इस स्थिति को कार्बन डाईआक्साइड को निकाल कर प्रतिवर्तित कर सकती है, जिससे पीएच वापस बढ़ जाता है.[26]
डीआक्सीहीमोग्लोबिन हीमोग्लोबिन का बंधित आक्सीजन से रहित प्रकार होता है. आक्सीहीमोग्लोबिन और डीआक्सीहीमोग्लोबिन के अवशोषणक के वर्णक्रम भिन्न होते हैं. आक्सीहीमोग्लोबिन का डीआक्सीहीमोग्लोबिन की अपेक्षा 660 एनएम तरंगदैर्घ्य का काफी कम अवशोषण होता है, जबकि 940 एनएम पर इसका अवशोषण जरा सा अधिक होता है. इसी कारण हीमोग्लोबिन का रंग लाल और डीआक्सीहीमोग्लोबिन का रंग नीला होता है. इस भिन्नता का प्रयोग पल्स आक्सीमीटर नामक यंत्र द्वारा रोगी के रक्त में आक्सीजन की मात्रा को मापने के लिये किया जाता है.
आक्सीहीमोग्लोबिन में लौह की आक्सीकरण स्थिति
संपादित करेंआक्सीकृत हीमोग्लोबिन की आक्सीकरण स्थिति निश्चित करना कठिन है क्यौंकि प्रायौगिक मापन से आक्सीहीमोग्लोबिन (एचबी-ओटू) डायामैग्नेटिक होती है (कोई अयुगल इलेक्ट्रान नहीं होते), फिर भी आक्सीजन और लौह दोनों में कम-ऊर्जा वाली इलेक्ट्रान संरचनाएं पैरामैग्नेटिक होती हैं (यानी इस यौगिक में कम से कम एक अयुगल इलेक्ट्रान होता है). आक्सीजन और उससे संबंधित लौह की आक्सीकरण दशाओं के न्यूनतम-ऊर्जा प्रकार निम्न हैं:
- न्यूनतम ऊर्जा वाली आक्सीजन की जाति, ट्रिप्लेट आक्सीजन में बंधनविरोधी π* आण्विक आर्बाइटलों में दो अयुगल इलेक्ट्रान होते हैं.
- लौह (II) एक हाई-स्पिन संरचना में होता है जहां अयुगल इलेक्ट्रान Eg बंधनविरोधी आर्बाइटलों में होते हैं.
- लौह (III) में इलेक्ट्रानों की अयुग्म संख्या होती है और इसलिये उसमें किसी भी ऊर्जा स्थिति में एक या अधिक अयुगल इलेक्ट्रान होना आवश्यक होता है.
ये सभी संरचनाएं डायामैग्नेटिक न होकर, पैरामैग्नेटिक (अयुगल इलेक्ट्रान युक्त) होती हैं. इस तरह, देखे गए डायामैग्नेटिज्म और अयुगल इलेक्ट्रानों को समझने के लिये लौह और आक्सीजन के संयोग में इलेक्ट्रनों का एक असहज वितरण होना जरूरी है.
डायामैग्नेटिक (बिना नेट स्पिन के) एचबी-ओटू के उत्पादन के लिये तीन संभावनाएं हैं:
- कम-स्पिन का Fe2+ सिंग्लेट आक्सीजन से बंधित होता है. कम-स्पिन लौह और सिंग्लेट आक्सीजन, दोनों डायामैग्नेटिक होते हैं. लेकिन, आक्सीजन का सिंग्लेट प्रकार अणु का उच्चतर-उर्जा प्रकार होता है.
- कम-स्पिन Fe3+ का बंधन. O2- (सुपरआक्साइड आयन) से होता है और दो अयुगल इलेक्ट्रान प्रतिफेरोमैग्नेटिकीय तरीके से युग्म बन जाते हैं, जिनमें डायामैग्नेटिक गुण होते हैं.
- कम स्पिन Fe4+ का बंधन पराक्साइड,O22- से होता है. दोनों ही डायामैग्नेटिक होते हैं.
सीधी प्रायौगिक जानकारी
- एक्स-रे फोटोइलेक्ट्रान स्पेक्ट्रोस्कोपी के अनुसार लौह की आक्सीकरण स्थिति लगभग 3.2 होती है.
- O-O बांड की इन्फ्रारेड आवृत्तियों के अनुसार बांध की लंबाई सुपरआक्साइड (बांड आर्डर करीब 1.6, और सुपरआक्साइड 1.5) के अनुकूल होती है.
इस तरह, एचबी-ओटू में लौह की सबसे नजदीकी औपचारिक स्थिति आक्सीकरण +3 दशा होती है, जिसमें आक्सीजन -1 दशा (सुपरआक्साइड. O2- के रूप में) में होती है. इस संरचना में डायामैग्नेटिज्म सुपरआक्साइड पर मौजूद एकल अयुगल इलेक्ट्रान के लौह पर स्थित एकल अयुगल इलेक्ट्रान से प्रतिफेरोमैग्नेटिक तरीके से व्यवस्थित होने से उत्पन्न होता है, जिससे प्रयोग के डायामैग्नेटिक आक्सीहीमोग्लोबिन के अनुसार, सारी संरचना को कोई कुल स्पिन नहीं प्राप्त होती.[27][28]
डायामैग्नेटिक आक्सीहीमोग्लोबिन के लिये ऊपर दी गई तीन संभावनाओं में से दूसरी का प्रयोग द्वारा सही पाया जाना आश्चर्यपूर्ण नहीं है– सिंग्लेट आक्सीजन (संभावना सं. 1) और चार्ज के बड़े विभाजन (संभावना सं. 3) दोनों प्रतिकूल उच्च-ऊर्जा दशाएं हैं. एचबी-ओटू में लौह का उच्चतर आक्सीकरण स्थिति में जाना अमु के आकार को कम कर देता है, जिससे वह पारफाइरिन रिंग के तल पर चला जाता है और कोआर्डीनेटेड हिस्टिडिन रेजिड्यू को खींच कर ग्लाबुलिनों में देखे जाने वाले ऐलोस्टीयरिक परिवर्तनों की शुरूआत करता है.
जैव-अकार्बनिक रसायनज्ञों द्वारा प्रस्तुत प्रारंभिक सिद्धांतों के अनुसार संभावना सं. 1 सही थी और लौह को आक्सीकरण दशा II. में होना चाहिये. ऐसा इसलिये लगता था क्यौंकि लौह की मेटहीमोग्लोबिन के रूप में आक्सीकरण दशा III, जब .O2- इलेक्ट्रान को "पकड़नें" के लिये सुपरआक्साइड मौजूद न हो, तो हीमोग्लोबिन को हवा में मौजूद सामान्य ट्रिप्लेट O2 को बांधनें में अक्षम बना देती है. इसलिये यह मान लिया गया कि जब आक्सीजन गैस फेफड़ों में बंधी होती है, तो लौह Fe(II) के रूप में रहता है. इस पहले वाले क्लासिक मॉडल में लौह का रसायनशास्त्र लुभावना था, लेकिन डायामैग्नेटिक उच्च-ऊर्जा सिंग्लेट आक्सीजन की आवश्यकता कभी समझ में नहीं आई. यह तर्क दिया गया कि आक्सीजन अणु का बंधन उच्च स्पिन लौह (II) को सशक्त-क्षेत्रीय लाइगैंडों के एक आक्टाहेड्राल क्षेत्र में रख देता है –क्षेत्र में इस परिवर्तन से स्फटिक क्षेत्र में वृद्धि से उर्जा का विभाजन हो जाता है, जिससे लौह के इलेक्ट्रान जोड़े बनाकर कम-स्पिन वाली संरचना का निर्माण करते हैं, जो Fe(II) में डायामैग्नेटिक होते हैं. यह जबरन कम-स्पिन युग्लीकरण आक्सीजन के बंधने पर होता है, लेकिन यह लौह के आकार में परिवर्तन को समझाने के लिये काफी नहीं है. लौह के छोटे आकार और बढ़ी हुई आक्सीकरण दशा, व आक्सीजन के कमजोर बांड को समझने के लिये आक्सीजन द्वारा लौह से एक अतिरिक्त इलेक्ट्रान को निकालना आवश्यक है.
यह ध्यान में रखना चाहिये कि पूर्ण-संख्या आक्सीकरण दशा का निर्धारण एक औपचारिकावाद है, क्यौंकि पूर्ण इलेक्ट्रान-अंतरण में दोषहीन बांड क्रमों के लिये कोवैलेंट बांडों का होना आवश्यक नहीं है. इस तरह पैरामैग्नेटिक एचबी-ओटू के तीनों माडल कुछ हद तक एचबी-ओटू की वास्तविक इलेक्ट्रानिक संरचना के लिये जिम्मेदार हो सकते हैं. लेकिन Fe(II) की अपेक्षा एचबी-ओटू में लौह का माडल का Fe(III) होना अधिक सही लगता है.
लाइगैंड बाइंडिंग
संपादित करेंआक्सीजन लाइगैंड के अतिरिक्त, जो हीमोग्लोबिन को सहकारी रूप से बांधे रखता है, हीमोग्लोबिन लाइगैंडों में स्पर्धात्मक अवरोधक जैसे, कार्बन मोनोआक्साइड (सीओ) व ऐलोस्टीयरिक लाइगैंड जैसे कार्बन डाईआक्साइड (CO2) भी शामिल हैं.
सहकारी
संपादित करें
जब आक्सीजन लौह काम्पलेक्स से बंधित होती है, तो इसके कारण लौह का परमाणु पॉरफाइरिन रिंग के तल के केंद्र की ओर चला जाता है. उसी समय हिस्टिडीन अवशेष की लौह के दूसरे ध्रुव से अंतर्क्रिया करती इमिडाजोल सह-श्रृंखला पॉरफाइरिन रिंग की ओर खिंच जाती है. इस अंतर्क्रिया के कारण रिंग का तल टेट्रामर के बाहर की तरफ एक ओर झुक जाता है और लौह परमाणु के पास जाते हुए हिस्टिडीन युक्त प्रोटीन हेलिक्स में भी दबाव उत्पन्न कर देता है. यह दबाव टेट्रामर के बाकी तीनों मोनोमरों की ओर संचरित हो जाता है, जिससे अन्य हीम स्थलों में भी समान तरह के परिवर्तन होने लगता है और इन स्थलों से आक्सीजन का बंधन आसान हो जाता है.
इस तरह, सामान्य वयस्क हीमोग्लोबिन के टेट्रामरिक प्रकार में, आक्सीजन का बंधीकरण एक सहकारी प्रक्रिया है. हीमोग्लोबिन की आक्सीजन के प्रति बंधन का आकर्षण अणु की आक्सीजन संतृप्तता से बढ़ती है– पहले बंधित आक्सीजनें बंधक स्थलों के आकार को अगली आक्सीजनों के लिये इस तरह से प्रभावित करती हैं कि वे बंधन के लिये अनुकूलित हो जाती हैं. यह सकारात्मक सहकारी बंधनक्रिया ऊपर चर्चित हीमोग्लोबिन प्रोटीन काम्प्लेक्स के स्टीयरिक परिवर्तनों के जरिये संभव होती है, अर्थात् जब हीमोग्लोबिन का एक उपइकाई प्रोटीन आक्सीजनित होता है, तो सारे काम्प्लेक्स में एक परिवर्तन शुरू हो जाता है, जिससे अन्य उपइकाइयों में आक्सीजन के प्रति आकर्षण बढ़ जाता है. परिणामस्वरूप, हीमोग्लोबिन का आक्सीजन बंधन वक्र सिग्मा, या S के आकार का होता है, जबकि असहकारी बंधनक्रिया से संबंधित सामान्य वक्र अतिपरवलीय होता है.
हीमोग्लोबिन में सहकारिता की गतिशील प्रक्रिया और कम आवृति की प्रतिध्वनि से इसके संबंध के बारे में चर्चा की जा चुकी है. [29] जैवमहाअणुओं में कम- आवृतिक सामूहिक गतियों और उसकी जीववैज्ञानिक क्रिया के बारे में और जानकारी के लिये देखें, प्रोटीनों और डीएनए में कम-आवर्तिक सामूहिक गति.
स्पर्धात्मक
संपादित करेंहीमोग्लोबिन की आक्सीजन-बंधक क्षमता कार्बन मोनोआक्साइड की उपस्थिति में कम हो जाती है क्यौंकि दोनों गैसें हीमोग्लोबिन पर एक ही बंधक स्थलों के लिये स्पर्धा करती हैं, जिसमें आक्सीजन की जगह कार्बन मोनोआक्साइड का बंधन को प्राथमिकता मिलती है.
आक्सीजन का बंधन कार्बन मोनो आक्साइड (सीओ) जैसे अणुओं से प्रभावित होता है.(उदा. तम्बाखू के धूम्रपान, कार के धुंए और भट्टियों में अपूर्ण दाहन से). सीओ हीम बंधन स्थल पर आक्सीजन से स्पर्धा करती है. सीओ की हीमोग्लोबिन बंधन आकर्षण उसके आक्सीजन से आकर्षण से 200 गुना अधिक होता है[30], जिसका अर्थ है कि सीओ की छोटी सी मात्राएं हीमोग्लोबिन की आक्सीजन को वहन करने की क्षमता को नाटकीय रूप से कम कर देती हैं. जब हीमोग्लोबिन सीओ से संयुक्त होता है तो एक बहुत चमकीले लाल यौगिक का निर्माण करता है जिसे कार्बाक्सीहीमोग्लोबिन कहते हैं, जिससे सीओ की विषाक्तता से ग्रस्त व्यक्ति की त्वचा मृत्यु के बाद सफेद या नीली के बजाय गुलाबी दिख सकती है. जब उच्छ्वासित हवा में सीओ के 0.02% जितने कम स्तर होते हैं, सिरदर्द और मतली होती है, यदि सीओ की सांद्रता 0.1% तक बढ़ा दी जाय तो बेहोशी आ जाती है. भारी धूम्रपान करने वालों में, आक्सीजन के सक्रिय स्थलों का 20% तक सीओ द्वारा अवरूद्ध हो सकती हैं.
इसी तरह, हीमोग्लोबिन का सायनाइड (CN-), सल्फर मोनो आक्साइड (SO), नाइट्रोजन डाई आक्साइड (NO2) और हाइड्रोजन सल्फाइड (H2S) सहित सल्फाइडों (S2-) के प्रति भी स्पर्धात्मक बंधन आकर्षण होता है. ये सभी हीम में लौह से उसकी आक्सीकरण दशा को बदले बिना बंधित होते हैं, लेकिन आक्सीजन बंधन को अवरूद्ध करते हैं, जिससे गंभीर विषाक्तता होती है.
हीम समूह का लौह परमाणु शुरू में, आक्सीजन और अन्य गैसों के बंधन और परिवहन के लिये फेरस (Fe2+) आक्सीकरण दशा में होना चाहिये (यह ऊपर लिखे अनुसार आक्सीजन के बंधन के समय फेरिक दशा में बदल जाता है). बिना आक्सीजन के प्रारंभ में फेरिक (Fe3+) दशा में आक्सीकरण से हीमोग्लोबिन हेमीग्लोबिन ("hemi globin") या मेटहीमोग्लोबिन में परिणित हो जाता है, जो आक्सीजन को नहीं बांध सकता. सामान्य लाल रक्त कोशिकाओं में हीमोग्लोबिन को ऐसी स्थिति से बचाने के लिये एक रिडक्शन तंत्र होता है. नाइट्रोजन डाई आक्साइड और नाइट्रस आक्साइड हीमोग्लोबिन की छोटी सी मात्रा को मेटहीमोग्लोबिन में बदलने की क्षमता रखते हैं, लेकिन सामान्यतः यह स्वास्थ्य की दृष्टि से महत्वपूर्ण नहीं है (नाइट्रोजन डाई आक्साइड अन्य प्रक्रियाओं से विषाक्त होती है, और नाइट्रस आक्साइड का प्रयोग अधिकांश लोगों में सर्जिकल एनेस्थीसिया में बिना किसी अनावश्यक मेटहीमोग्लोबिन के जमाव के किया जाता है).
ऐलोस्टीयरिक
संपादित करेंकार्बन डाई आक्साइड हीमोग्लोबिन पर एक भिन्न बंधन स्थल पर स्थित होती है. कार्बन डाई आक्साइड आक्सीजनहीन रक्त में आसानी से घुल जाती है, जिससे चयापचय करते ऊतकों में आक्सीजन के पहुंचने के बाद कार्बन डाई आक्साइड को सरलता से शरीर के बाहर निकाला जा सकता है. शिराओं के रक्त का कार्बन डाई आक्साइड के प्रति यह आकर्षण हाल्डेन प्रभाव कहलाता है. एंजाइम कार्बानिक एनहाइड्रेज के जरिये कार्बन डाई आक्साइड पानी से प्रतिक्रिया करके कार्बानिक एसिड देती है, जो बाईकार्बोनेट और प्रोटानों में विघटित हो जाता है -
- CO2 + H2O → H2CO3 → HCO3- + H+
इस तरह उच्च कार्बन डाई आक्साइड वाला रक्त कम पीएच वाला (अधिक अम्लीय) होता है. हीमोग्लोबिन प्रोटानों और कार्बन डाई आक्साइड को बंधित कर सकता है, जिससे प्रोटीन में परिवर्तन हो जाता है और आक्सीजन मुक्त होती है. प्रोटान प्रोटीन पर कई स्थानों पर बंधित होते हैं, जबकि कार्बन डाई आक्साइड α-अमाइनो समूह पर बंधित होती है.[31] कार्बन डाई आक्साइड हीमोग्लोबिन से बंधित होकर कार्बमिनोहीमोग्लोबिन बनाती है.[32] कार्बन डाई आक्साइड और एसिड के बंधन द्वारा हीमोग्लोबिन के आक्सीजन के प्रति आकर्षण में कमी (ओटू-संतृप्तता वक्र दांयी ओर चला जाता है) को बोह्र प्रभाव कहते हैं. इसके विपरीत, जब रक्त में कार्बन डाई आक्साइड के स्तर कम हो जाते हैं (अर्थात् फेफड़ों की केशिकाओं में), तो हीमोग्लोबिन से कार्बन डाई आक्साइड और प्रोटान मुक्त हो जाते हैं, जिससे प्रोटीन का आक्सीजन के प्रति आकर्षण बढ़ जाता है.
बंधित की हुई आक्सीजन को हीमोग्लोबिन द्वारा मुक्त किया जाना आवश्यक होता है, वरना उसके बंधित होने का कोई मतलब ही नहीं है. हीमोग्लोबिन का सिग्मायडल वक्र उसे बंधन (फेफड़ों में O2 लेना) और मुक्तन (उतकों में O2 को मुक्त करना) के लिये सक्षम बना देता है.[33]
उंचे स्थानों के मौसम के प्रति अनुकूलित लोगों में, रक्त में 2,3-बाईफास्फोग्लिसरेट (2,3-बीपीजी) की सांद्रता बढ़ जाती है, जिससे ये लोग कम आक्सीजन के तनाव की स्थिति में ऊतकों को आक्सीजन की अधिक मात्रा दे सकते हैं. इस प्रक्रिया को, जिसमें अणु Y अणु X के परिवहन अणु Z से बंधन को प्रभावित करता है, हीटरोट्रापिक एलोस्टीयरिक प्रभाव कहते हैं.
एक भिन्न हीमोग्लोबिन, जिसे फीटल हीमोग्लोबिन (एचबीएफ, α2γ2) कहते हैं, विकसित हो रहे शिशु में पाया जाता है और आक्सीजन को वयस्क हीमोग्लोबिन की अपेक्षा अधिक आकर्षण से बांधता है. इसका मतलब है कि वयस्क हीमोग्लोबिन की तुलना में फीटल हीमोग्लोबिन का आक्सीजन बंधक वक्र बाईं ओर झुका होता है. (आक्सीजन हीमोग्लोबिन के अधिकांश प्रतिशत से कम आक्सीजन तनाव पर बंधित होती है). फलतः अपरा का शिशु रक्त माता के रक्त से आक्सीजन ले सकता है.
हीमोग्लोबिन अणु के ग्लोबिन भाग में नाइट्रिक आक्साइड का भी वहन करता है. इससे परिधि के भाग में आक्सीजन के पहुंचने में मदद मिलती है और श्वसनक्रिया नियंत्रित होती है. एनओ ग्लोबिन में एक विशिष्ट सिस्टीन अवशेष से आवर्ती रूप से बंधी होती है. यह बंधन हीमोग्लोबिन की स्थिति (आर या टी) पर निर्भर होता है. इससे प्राप्त एस-नाइट्रोसिलेटेड हीमोग्लोबिन विभिन्न एनओ-संबंधित क्रियाओं जैसे, नलिका अवरोध, रक्तचाप और श्वसनक्रिया को प्रभावित करता है. एनओ लाल रक्त कमों के साइटोप्लाज्म में मुक्त नहीं होता लेकिन एई1 नामक एक एनायन विनिमयक द्वारा उनमें सें बाहर परिवहित किया जाता है.[34]
रक्त (मानव व पशुओं के) में सांस में भीतर लिये गए अस्थिर कार्बनिक यौगिकों (वीओसी) के विभाजन पर हीमोग्लोबिन के प्रकार के प्रभाव को देखने के लिये एक अध्ययन किया गया. इस शोध में जांच के लिये नमूने वीओसी के रूप में बेंजीन का प्रयोग किया गया, क्यौंकि इसके गुण अन्य कई वीओसियों से मिलते हैं. यह अध्ययन वीओसी के विभाजन कोशैंट (पीसी) पर एचबी की जल विलयनता के प्रभाव की तुलना हीमोग्लोबिन की अन्य जातियों या प्रकारों के प्रभाव से की गई है. प्रयोग में लाए गए विभिन्न रक्तों में शामिल हैं – मानव हीमोग्लोबिन (एचबीए, चूहे का एचबी और सिकल सैल हीमोग्लोबिन (एचबीएस). चूहे के एचबी में जल बहुत कम होता है और यह अर्ध-स्फटिक रूप में लाल रक्त कोशिकाओं (आरबीसी) में होता है, यानी यह जल में घुलनशील मानव रक्त की तुलना में अधिक हाइड्रोफोबिक होता है. सिकल सैल हीमोग्लोबिन (एचजीएस) जल में घुलनशील होता है, लेकिन यह विआक्सीजनित होने पर जल में अघुलनशील होकर हाइड्रोफोबिक पालिमरों में बदल सकता है. निष्कर्षों के अनुसार चूहे के एचबी का बेंजीन पीसी मानव के एचबी के बेंजीन पीसी से काफी अधिक होता है, लेकिन एचबीए और एचबीएस के आक्सीजनित और विआक्सीजनित प्रकारों के पीसीओं के मापन की परीक्षाओँ में कोई भिन्नता नहीं पाई गई, जिससे यह संकेत मिलता है कि बेंजीन का आकर्षण एचबी की जल में घुलनशीलता से प्रभावित नहीं होता है.[35]
मनुष्यों में प्रकार
संपादित करेंहीमोग्लोबिनों के विभिन्न प्रकार भ्रूण और शिशु के सामान्य विकास का एक हिस्सा होते हैं, लेकिन किसी जनसमूह में आनुवंशिकी की भिन्नताओं के कारण उत्पन्न हीमोग्लोबिन के रूग्णताकारक विकृत प्रकार भी हो सकते हैं. कुछ मशहूर हीमोग्लोबिन प्रकार जैसे सिकल-सैल एनीमिया रोगों के लिये जिम्मेदार होते हैं और उन्हें हीमोग्लोबिनोपैथी कहा जाता है. अन्य प्रकारों से कोई विशेष रूग्णता नहीं होती, इसलिये उन्हें अरूग्णताकारक प्रकार कहते हैं.[36][37]
भ्रूण में -
शिशु में -
वयस्कों में -
- हीमोग्लोबिन ए (α2β2) ([68]) –सबसे आम,95% से अधिक मात्रा में
- हीमोग्लोबिन एटू (α2δ2) – δ श्रृंखला संश्लेषण तीसरे त्रैमासिक में शुरू होता है और वयस्कों में इसका सामान्य स्तर 1.5-3.5% होता है.
- हीमोग्लोबिन एफ (α2γ2) –वयस्कों में हीमोग्लोबिन एफ, एफ-कोशिका नामक कुछ सीमित लाल कोशिकाओं में ही होता है. लेकिन एचबी एफ का स्तर सिकल-सैल एनीमिया से ग्रस्त लोगों में बढ़ सकता है.
रोग उत्पन्न करने वाले प्रकार -
- हीमोग्लोबिन एच (β4) - β श्रृंखलाओं के एक टेट्रामर द्वारा उत्पन्न हीमोग्लोबिन का एक प्रकार, जो α थैलेसीमिया के प्रकारों में पाया जा सकता है.
- हीमोग्लोबिन बार्ट्स (γ4) - γ श्रृंखलाओं के एक टेट्रामर द्वारा उत्पन्न हीमोग्लोबिन का एक प्रकार जो α थैलेसीमिया के प्रकारों में पाया जा सकता है.
- हीमोग्लोबिन एस (α2βS2) – सिकल सेल रोगियों में पाया जाने वाला हीमोग्लोबिन का एक प्रकार. इसमें β-श्रृंखला जीन में भिन्नता होती है, जिससे हीमोग्लोबिन के गुण बदल जाते हैं और लाल रक्तकोशिकाओं की सिक्लिंग होती है.
- हीमोग्लोबिन सी (α2βC2) - β-श्रृंखला में परिवर्तन के कारण उत्पन्न एक और प्रकार. इस प्रकार के कारण एक हल्की दीर्घकालिक हीमोलाइटिक रक्ताल्पता होती है.
- हीमोग्लोबिन ई (α2βE2) - β-श्रृंखला में परिवर्तन के कारण उत्पन्न एक और प्रकार. इस प्रकार के कारण एक हल्की दीर्घकालिक हीमोलाइटिक रक्ताल्पता होती है.
- हीमोग्लोबिन एएस –सिकल सेल ट्रेट को उत्पन्न करने वाला एक प्रकार जिसमें एक वयस्क जीन और एक सिकल सेल जीन होती है.
- हीमोग्लोबिन एससी रोग –एक सिकल सेल जीन व दूसरी हीमोग्लोबिन सी की जीन वाला एक और प्रकार.
पृष्ठवंशी पशुओं अपक्षय
संपादित करेंजब लाल कोशिकाएं उम्र या विकारों के कारण अपने जीवन के अंत को पहुंचती हैं, तो वे फूट जाती हैं, हीमोग्लोबिन अणु फूट जाता है और लौह का पुनःउपयोग होता है. जब पॉरफाइरिन रिंग बिखरती है, तो उसके अवशेष सामान्यतः यकृत द्वारा पित्तरस में स्रवित किये जाते हैं. इस प्रक्रिया से हीम के हर अणु के लिये एक कार्बन मोनोक्साइड अणु भी उत्पन्न होता है. यह मानव शरीर में कार्बन मोनोक्साइड के उत्पादन के चंद स्रोतों में से एक है और शुद्ध हवा में सांस ले रहे लोगों में भी कार्बन मोनोक्साइड के सामान्य रक्त स्तरों के लिये जिम्मेदार है. हीम अपक्षय का दूसरा मुख्य उत्पाद बिलिरूबिन है.यदि लाल रक्त कोशिकाएं सामान्य से अधिक तेजी से नष्ट हो रही हों तो इस रसायन के बढ़े हुए स्तर रक्त में पाए जा सकते हैं. रक्त कोशिकाओं से निकले गलत तरीके से अपक्षयित हीमोग्लोबिन प्रोटीन या हीमोग्लोबिन से छोटी रक्त नलिकाएं, विशेषकर गुर्दों की रक्त को छानने वाली नाजुक नलिकाएं तेजी से अवरूद्ध हो सकती हैं, जिससे गुर्दों को हानि पहुंच सकती है.
रोगों में भूमिका
संपादित करेंहीमोग्लोबिन की कमी हीमोग्लोबिन अणुओं की मात्रा में कमी, जैसे एनीमिया में, या प्रत्येक अणु की आक्सीजन के समान आंशिक दबाव पर आक्सीजन को बांधने की क्षमता में कमी के कारम हो सकती है. हीमोग्लोबिनोपैथियां (आनुवंशिक विकारों से उत्पन्न हीमोग्लोबिन की असामान्य रचना) इन दोनों का कारण हो सकती हैं. हर हाल में, हीमोग्लोबिन की कमी रक्त की आक्सीजन को वहन करने की क्षमता को घटा देती है. साधारणतया, हीमोग्लोबिन की कमी को रक्त में आक्सीजन की कमी, या रक्त में आक्सीजन के आंशिक दबाव में कमी, से अलग पहचानना चाहिये, हालांकि दोनों ही अल्पआक्सीयता (ऊतकों को अपर्याप्त आक्सीजन की उपलब्धि) के कारणों में शामिल हैं. Retrieved on May 25, 2009</ref>[38][73][74] although both are causes of hypoxia (insufficient oxygen supply to tissues).
कम हीमोग्लोबिन के अन्य आम कारणों में, रक्त का ह्रास, पोषण की कमी, रक्त मज्जा समस्याएं, कीमोथेरेपी, गुर्दों का काम न करना, या असामान्य हीमोग्लोबिन (जैसे सिकल सेल रोग में) आदि शामिल हैं.
ऊंचे स्थानों पर जाने, धूम्रपान, निर्जलीकरण, या ट्यूमरों के कारण उच्च हीमोग्लोबिन स्तर हो सकते हैं.
प्रत्येक हीमोग्लोबिन अणु की आक्सीजन के वहन की क्षमता सामान्यतः परिवर्तित रक्त पीएच या कार्बन डाई आक्साइड द्वारा संशोधित होती है, जिससे एक परिर्वर्तित आक्सीजन-हीमोग्लोबिन विघटन वक्र बनता है. यह भी रोगों द्वारा बदला जा सकता है, उदा.कार्बन मोनोक्साइड विषाक्तता.
लाल रक्त कोशिकाओं की कमी के साथ या उसके बिना हीमोग्लोबिन की मात्रा में कमी से रक्ताल्पता ते लक्षण उत्पन्न होते हैं. रक्ताल्पता के कई कारण होते हैं, हालांकि पाश्चात्य विश्व में लौह की कमी और उससे उत्पन्न लौह की कमी वाली रक्ताल्पता इसके मुख्य कारण हैं. चूंकि लौह की अनुपस्थिति के कारण हीम संश्लेषण में कमी आती है, इसलिये लौह की कमी वाली रक्ताल्पता में लाल रक्त कोशिकाएं हल्के लाल रंग (हाइपोक्रोमिक-लाल हीमोग्लोबिन वर्णक का अभाव) की और आकार में छोटी (माइक्रोसाइटिक) दिखती हैं. अन्य रक्ताल्पताएं विरल होती हैं. हीमोलाइसिस (लाल रक्त कोशिकाओं का अधिक तेजी से नष्ट होना) में हीमोग्लोबिन चयापचयक बिलिरूबिन के कारण पीलिया हो जाता है, और रक्त में प्रवाहित हो रहे हीमोग्लोबिन के कारण गुर्दे नाकाम हो सकते हैं.
ग्लोबिन श्रृंखला के कुछ विकारों का संबंध हीमोग्लोबिनोपैथियों से होता है, जैसे सिकल सैल रोग और थैलेसीमिया. अन्य विकार, जैसा कि इस लेख के प्रारंभ में कहा गया है, मृदु होते हैं और केवल हीमोग्लोबिन प्रकारों के रूप में वर्णित किये जाते हैं.
पॉरफाइरिया नामक आनुवंशिक रोगों के एक समूह में हीम संश्लेषण के चयापचयी मार्गों की त्रुटियां पाई जाती हैं. युनाइटेड किंगडम का किंग जार्ज III संभवतः इस रोग का सबसे प्रसिद्ध रोगी था.
कुछ कम हद तक, हीमोग्लोबिन ए प्रत्येक बीटा श्रृंखला के वैलाइन टर्मिनल (एक अल्फा अमाइनो एसिड) पर ग्लुकोज से धीरे-धीरे संयुक्त होता है.इससे प्राप्त अणु को अकसर एचबीए1सी कहते हैं. जैसे-जैसे रक्त में ग्लुकोज की मात्रा बढ़ती है, एचबीए1सी में बदल रहे एचबीए का प्रतिशत भी बढ़ता है. जिन मधुमेह के रोगियों में ग्लुकोज अधिक होता है, उनका एचबीए1सी भी अधिक होता है. ग्लुकोज से एचबीए के संयुक्त होने की दर के धीमे होने के कारण एचबीए1सी का प्रतिशत लंबे समय में (लाल रक्त कोशिकाओं का अर्धजीवन, जो 50-55 दिन होता है) रक्त में ग्लुकोज के स्तर के औसत का प्रतिनिधित्व करता है.
ग्लाइकोसिलेटेड हीमोग्लोबिन हीमोग्लोबिन का वह प्रकार है जो ग्लुकोज से संयुक्त रहता है. ग्लुकोज हीमोग्लोबिन से लाल रक्त कोशिकाओं के जीवन-पर्यंत संयुक्त रहता है, जो लगभग 120 दिन होता है. ग्लाइकोसिलेटेड हीमोग्लोबिन के स्तरों को टाइप 2 मधुमेह (टा2डीएम) के रोग के लंबे समय में नियंत्रण की निगरानी के लिये मापा जाता है. टा2डीएम के ठीक से नियंत्रित न होने पर लाल रक्त कोशिकाओं में ग्लाइकोसिलेटेड हीमोग्लोबिन के स्तर बढ़ जाते हैं. सामान्यतः यह लगभग 4-5.9% होना चाहिये. कठिन होने पर भी, टा2डीएम के रोगियों के लिये इसे 7%. से कम रखने की सलाह दी जाती है.9%. से अधिक के स्तर ग्लाइकोसिलेटेड हीमोग्लोबिन के बुरे नियंत्रण का प्रतीक होते हैं, और 12%. से अधिक का स्तर बहुत बुरा नियंत्रण माना जाता है. जिन रोगियों का ग्लाइकोसिलेटेड हीमोग्लोबिन स्तर 7%. के आस-पास होता है उनमें मधुमेह से उत्पन्न जटिलताएं होने की संभावना काफी कम हो जाती हैं (उन लोगों की तुलना में जिनमें इसका स्तर 8%. या अधिक होता है).
टा2डीएम के रोगियों के ग्लाइकोसिलेटेड हमोग्लोबिन स्तरों पर दो भिन्न प्रकार के अभ्यास कार्यक्रमों (संयुक्त एयरोबिक व पर्तिरोधी व्यायाम कार्यक्रम और केवल एयरोबिक व्यायाम) के प्रभाव को परखने के लिये एक शोध किया गया -
इस जांच में कुल ग्लुकोज नियंत्रण को ग्लाइकोसिलेटेड हीमोग्लोबिन (एचबीए या ए) के रूप में मापा गया. प्रतिरोधी व्यायाम को एयरोबिक व्यायाम से संयुक्त करने पर ग्लुकोज नियंत्रण केवल एयरोबिक की तुलना में बेहतर हुआ. अभ्यास कार्यक्रमों के औसत प्रभाव में ग्लाइकोसिलेटेड हीमोग्लोबिन में 0.8%. की कमी शामिल थी जो लंबे अर्से तक आहार और दवा या इंसुलिन उपचार के परिणामों (0.6-0.8%. की कमी) के समान थी.
हीमोग्लोबिन के बढ़े हुए स्तर का संबंध लाल रक्त कोशिकाओं की अधिक संख्या या आकार से होता है, जिसे पॉलिसाइथीमिया कहते हैं. यह वृद्धि जन्मजात हृदय रोग, कॉर पल्मोनेल, फुफ्फुसीय फाइब्रोसिस, बहुत अधिक एरिथ्रोपाइटिन, या पॉलिसाइथीमिया वेरा के कारण होती है.
योग निद्रा नामक योगाभ्यास रोज आधे घंटे तक करने के एक अध्ययन में हीमोग्लोबिन के स्तरों में वृद्धि देखी गई.
नैदानिक उपयोग
संपादित करेंहीमोग्लोबिन की मात्रा का मापन सबसे अधिक किये जाने वाली रक्त जांचों में से एक है, और सामान्यतः संपूर्ण रक्त गणना के एक भाग के रूप में किया जाता है. उदा. इसकी जांच रक्तदान के पहले या बाद में की जाती है.परिणामों को ग्रा प्रति ली, ग्रा प्रति डीएल या मॉल प्रति ली में व्यक्त किया जाता है. 1 ग्रा प्रति डीएल लगभग 0.15 मिलीमॉल प्रति ली के बराबर होता है. सामान्य स्तर हैं:
- पुरूष: 13.8 to 18.2 g/dL (138 onto 182 g/L, or 2.15 mM to 2.8 mM (mmol/L))
• स्त्रियां: 12.1 to 15.1 g/dL (121 to 151 g/L, or 1.89 mM to 2.35 mM)
• बच्चे: 11 to 16 g/dL (111 to 160 g/L, or 1.73 mM to 2.5 mM)
• गर्भवती स्त्रियां: 11 to 12 g/dL (110 to 120 g/L, or 1.73 mM to 1.89 mM)
गर्भवती स्त्रियों के पहले और तीसरे त्रैमासिकों में हीमोग्लोबिन का सामान्य स्तर कम से कम 11 ग्रा/डीएल और दूसरे त्रैमासिक में कम से कम 10.5 ग्रा/डीएल होना चाहिये.
यदि मात्रा सामान्य से कम हो, तो इसे रक्ताल्पता कहा जाता है. रक्ताल्पताओं को लाल रक्त कोशिकाओं के आकार के अनुसार वर्गीकृत किया जाता है. यदि लाल कोशिकाएं छोटी हों तो, रक्ताल्पता को माइक्रोसाइटिक, बड़ी हों तो मैक्रोसाइटिक, अन्यथा नार्मोसाइटिक कहा जाता है.
रक्त के आयतन में लाल रक्त कोशिकाओं का अनुपात, हेमेटोक्रिट, सामान्यतः हीमोग्लोबिन के स्तर का करीब तीन गुना होता है. उदा. यदि हीमोग्लोबिन की मात्रा 17 हो तो, हेमेटोक्रिट 51 होगा.
रक्त शर्करा की मात्रा का दीर्घकालिक नियंत्रण एचबीए1सी की मात्रा को माप कर किया जा सकता है. इसका सीधा मापन करने के लिये की नमूनों की आवश्यकता होती है क्यौंकि रक्त शर्करा के स्तर दिन भर में काफी भिन्न हो सकते हैं. एचबीए1सी हीमोग्लोबिन ए के ग्लुकोज से हुई प्रतिक्रिया का परिणाम होता है. ग्लुकोज की अधिक मात्रा होने पर एचबीए1सी अधिक होता है. चूंकि यह प्रतिक्रिया धीमी होती है, एचबीए1सी का अनुपात लाल रक्त कोशिकाओं के अर्ध-जीवनकाल (50-55दिन) में रक्त में ग्लुकोज के स्तर के औसत का प्रतिनिधित्व करता है. एचबीए1सी का 6.0प्रतिशत या उससे कम का अनुपात ग्लुकोज का अच्छा दीर्घकालिक नियंत्रण माना जाता है, जबकि 7.0 प्रतिशत से अधिक. का स्तर अपर्याप्त नियंत्रण समझा जाता है. यह जांच मधुमेह के रोगियों के लिये विशेषकर उपयोगी है.
फंक्शनल मैग्नेटिक रेजनेंस इमेजिंग मशीन डीआक्सीहीमोग्लोबिन से इस संकेत का प्रयोग करती है, जो चुम्बकीय क्षेत्रों के प्रति संवेदनशील होता है.
गैर हड्डीवाला अवयव में अनालोगुएस
संपादित करेंसारे पशु और वनस्पति संसार में जीवों में अनेक आक्सीजन-परिवहन और बंधक प्रोटीन पाए जाते हैं. बैक्टीरिया, प्रटोजोआ, और फफूंदी सभी जीवों में हीमोग्लोबिन जैसे प्रोटीन होते हैं, जिनकी ज्ञात व अपेक्षित भूमिकाओं में गैसीय लाइगैंडों का बंधन करना शामिल होता है. चूंकि इन प्रोटीनो में से अनेकों में ग्लोबिन और हीम भाग (पारफाइरिन के सहारे मौजूद लौह) होते हैं, इन्हें अकसर हीमोग्लोबिन कहा जाता है, भले ही उनकी रचना पृष्ठवंशी हीमोग्लोबिन से बहुत भिन्न क्यौ न हो.विशेषकर निचले दर्जे के जीवों में मयोग्लोबिन और हीमोग्लोबिन में फर्क करना अकसर असंभव होता है, क्यौंकि इनमें से कुछ जीवों में मांसपेशियां नहीं होतीं. या, उनमें पहचानने योग्य अलग रक्तप्रवाह तंत्र तो होता है, लेकिन इसका आक्सीजन के परिवहन से संबंध नहीं होता.(उदा.अनेक कीट और अन्य आर्थोपाड). इन सभी समूहों में, गैस-बंधन से संबंधित हीम व ग्लोबिन युक्त अणु (मोनोमेरिक ग्लोबिन भी) हीमोग्लोबिन कहलाते हैं. आक्सीजन के परिवहन और पहचान के अलावा वे एनओ, सीओ2, सल्फाइड यौगिकों, और एनएयरोबिक पर्यावरणों में ओ2 की सफाई का काम भी करते हैं. वे हीम-युक्त पी450 एंजाइमों और पराक्सिडेजों की तरह क्लोरीनीकृत वस्तुओं के अविषाक्तीकरणृ का कार्य भी करते हैं.
हीमोग्लोबिनों की रचना विभिन्न जातियों में भिन्न होती है. हीमोग्लोबिन सभी जीव समुदायों में होता है, लेकिन सभी जीवों में नहीं. प्राचीन जातियों जैसे बैक्टीरिया, प्रोटोजोआ, शैवाल और पौधों में अकसर एकल ग्लोबिन वाले हीमोग्लोबिन होते हैं. कई निमाटोड कीटों, मोलस्कों, और क्रूस्टेसियनों में बहुत बड़े अनेक उपइकाईयों वाले अणु होते हैं, जो पृष्ठवंशियों के अणुओं से काफी बड़े होते हैं. खास कर, फफूंदी और विराट एनेलिडों में पाए जाने वाले चिमेरिक हीमोग्लोबिनों में ग्लोबिन और प्रोटीनों के अन्य प्रकार हो सकते हैं.
जीवों में हीमोग्लोबिन के सबसे खास उपयोगों में से एक जायंट ट्यूब वर्म (रिफ्टिया पैचिप्टिला, या वेस्टीमेंटीफेरा), जो 2.4 मीटर तक लंबा हो सकता है और समुद्री ज्वालामुखी वेंटों में रहता है, में उसका उपयोग है. इन जीवों में पाचक नली की जगह जीव के वजन के आधे वजन के बैक्टीरिया होते हैं. ये बैक्टीरिया वेंट के एच2एस और पानी के ओ2 से प्रतिक्रिया करके ऊर्जा का उत्पादन करते हैं जिससे पानी और सीओ2 से भोजन बनता है. इन वर्मों के पिछले सिरे पर एक गहरी लाल पंखे जैसी रचना होती है, जो पानी में फैलती है और एच2एस और ओ2 का बैक्टीरिया के लिये, तथा प्रकाश-संश्लेषक पौधों की तरह संश्लेषित कच्चे माल के रूप में प्रयोग के लिये सीओ2 का अवशोषण करती है. ये रचनाएं उनमें मौजूद असाधारण रूप से जटिल हीमोग्लोबिनों के कारण चमकदार-लाल होती है, जिनमें 144 तक ग्लोबिन श्रृंखलाएं होती हैं, जिनमें प्रत्येक में संबंधित हीम रचनाएं होती हैं. ये हीमोग्लोबिन सल्फाइड की उपस्थिति में आक्सीजन और सल्फाइड का, अन्य जातियों के हीमोग्लोबिनों की तरह, बिना पूरी तरह विषाक्त हुए या अवरूद्ध हुए परिवहन करने की क्षमता रखते हैं.
आक्सीजन का बंधन करने वाले अन्य प्रोटीन
संपादित करेंमयोग्लोबिन – मानव समेत अनेक पृष्ठवंशियों के मांसपेशी ऊतकों में पाया जाता है.यह मांस पेशी ऊतक को एक स्पष्ट लाल या गहरा धूसर रंग देता है. यह रचना और श्रृंखला में हीमोग्लोबिन के जैसा ही होता है, लेकिन यह टैट्रामर न होकर मोनोमर होता है, जिसमें सहकारी बंधक गुण की कमी होता है. इस का प्रयोग आक्सीजन के परिवहन की जगह उसके भंडार के लिये किया जाता है.
हीमोसयानिन – प्रकृति में पाया जाने वाला दूसरा सबसे आम आक्सीजन का वहन करने वाला प्रोटीन, यह कई आर्थोपाडों और मोलस्कों के रक्त में होता है. लौह हीम समूहों की जगह इसमें तांबे के प्रास्थेटिक समूहों का प्रयोग होता है और आक्सीदनित होने पर यह नीले रंग का दिखता है.
हीमएरिथ्रिन – कुछ समुद्री अपृष्ठवंशी और एनेलिड जातियां उनके रक्त में आक्सीजन के परिवहन के लिये इस लौह युक्त गैर-हीम प्रोटीन का प्रयोग करती हैं. आक्सीजनित होने पर गुलाबी/बैंगनी दिखता है, और आक्सीजनित न होने पर रंगहीन दिखाई देता है.
क्लोरोक्रूओरिन – कई एनेलिडों में पाया जाने वाला, यह एरिथ्रोक्रुओरिन के बहुत समान होता है, लेकिन इस का हीम समूह रचना में बहुत भिन्न होता है. विआक्सीजनित होने पर हरा और आक्सीजनित होने पर लाल दिखता है.
वैनैबिन –इन्हें वैनेडियम क्रोमाजन भी कहते हैं, और ये समुद्री स्किर्टों के रक्त में पाए जाते हैं और यह समझा जाता है कि ये विरल धातु वैनेडियम को अपने आक्सीजन बंधक प्रास्थेटिक समूह के रूप में उपयोग में लाते हैं.
एरिथ्रोक्रुओरिन – केंचुओं सहित कई एनेलिडों में पाया जाने वाला, यह एक विराट मुक्त बहने वाला रक्त प्रोटीन है जिसमें, एक अकेले प्रोटीन काम्प्लेक्स में आपस में बंधी दर्जनों या संभवतः सैकड़ों लौह और हीमयुक्त प्रोटीन उपइकाईयां होती हैं, जिनका अणु भार 3.5 मिलियन डाल्टनों से भी अधिक होता है.
पिन्नाग्लोबिन – केवल मोलस्क पिन्ना स्क्वेमोसा में पाया जाता है. भूरा मैंगेनीज पर आधारित पॉरफआइरिन प्रोटीन.
लेगहीमोग्लोबिन – फली वाले पौधों, जैसे अल्फाल्फा या सोयाबीनों में, जड़ों के नाइट्रोजन को स्थिर करने वाले बैक्टीरिया की आक्सीजन से रक्षा इस लौह हीम युक्त आक्सीजन-बंधक प्रोटीन द्वारा की जाती है.प्रारक्षित विशिष्ट एंजाइम नाइट्रोजेनेज़ होता है, जो मुक्त आक्सीजन की उपस्थिति में नाइट्रोजन गैस का अपघटन करनें में असमर्थ होता है.
कोबोग्लोबिन – एक संश्लेषित कोबाल्ट पर आधारित पॉरफाइरिन.आक्सीजनित होने पर कोबोप्रोटीन रंगहीन दिखता है, पर शिराओं में यह पीला नजर आता है.
नोनेर्य्थ्रोइद कोशिकाओं में उपस्थिति
संपादित करेंकुछ नॉन एरिथ्रायड कोशिकाएं (यानी लाल रक्त कोशिका के अतिरिक्त प्रकार की कोशिकाएं) हीमोग्लोबिन युक्त होती हैं.मस्तिष्क में, सबस्टैंशिया निग्रा के ए9 डोपमिनर्जिक न्यूरान, सेरेब्रल कार्टेक्स और हिप्पोकैम्पस के ऐस्ट्रोसाइट, और सभी परिपक्व आलिगोडेंड्रोसाइट इनमें शामिल हैं.. ऐसा समझा जाता है कि, इन कोशिकाओं में मस्तिष्क हीमोग्लोबिन आक्सीजनहीन स्थितियों में होमियोस्टैटिक प्रक्रिया के लिये आक्सीजन के भंडारण को संभव करता है, जो ए9 डीए न्यूरानों के लिये खास तौर पर महत्वपूर्ण है, क्यौंकि उनमें ऊर्जा के उत्पादन के लिये अधिक चयापचय के साथ अधिक आक्सीजन की आवश्यकता पड़ती है. इसके अलावा, ए9 डोपमिनर्जिक न्यूरानों को विशेष जोखम होता है, क्योंकि वे स्वआक्सीकरण और मोनोअमाइन आक्सिडेज द्वारा किये गए डोपमिन को विअमाअनीकरण से उत्पन्न हाइड्रोजन पराक्साइड के कारण अत्यंत गहन आक्सीकरण दबाव में होते हैं, और जिनमें फेरस लौह की प्रतिक्रिया के कारण अत्यंत विषाक्त हाइड्राक्सिल मूलों का उत्पादन होता है. इससे पार्किन्सन रोग में इन कोशिकाओं के अपक्षय को खतरे को समझाया जा सकता है. इन कोशिकाओं में हीमोग्लोबिन के लौह की उपस्थिति के कारण मृत्यु के बाद ये कोशिकाएं गहरी पड़ जाती हैं, जिससे इन कोशिकाओं का लैटिन नाम सबस्टैंशिया निग्रा पड़ा है.
मस्तिष्क के बाहर, हीमोग्लोबिन का एंटीआक्सीटैंट और मैक्रोफैजों, अल्वियोलार कोशिकाओं, और गुर्दे की मेसेंजियल कोशिकाओं में लौह चयापचय का नियंत्रण जैसे गैर-आक्सीजन-परिवहन कार्य करना होता है.
इतिहास में कला और संगीत
संपादित करेंऐतिहासिक रूप से, रक्त के रंग का संबंध जंग से जोड़ा जाता था क्यौंकि प्राचीन रोमन मंगल गृह का संबंध उसके संतरे-लाल रंग के होने के कारण युद्ध के देवता से जोड़ते थे. मंगल का रंग उसकी धरती में लौह-आक्सीजन होने के कारण ऐसा होता है, लेकिन रक्त का लाल रंग हीमोग्लोबिन और उसके आक्साइडों में मौजूद लौह के कारण नहीं होता, जो कि एक मिथ्या है. लाल रंग हीमोग्लोबिन के पॉरफाइरिन भाग के कारण होता है, जिससे लौह बंधित होता है, न कि स्वयं लौह के कारण, हालांकि लौह की लाइगेशन और रिडॉक्स स्थिति परफाइरिन के पाई से पाई* इलेक्ट्रानिक परिवर्तनों को और इस तरह उसके आप्टिकल गुणों को प्रभावित कर सकती है.
कलाकार जुलियन वॉस-आंद्रे ने 2005 में ‘‘स्टील का हृदय (हीमोग्लोबिन)’’ नामक एक प्रतिमा का निर्माण किया, जो इस प्रोटीन की पृष्ठभूमि पर आधारित थी. यह प्रतिमा शीशे और स्टील से बनी थी. प्रारंभ में चमकीली इस कलाकृति पर जानबूझ कर जंग जमने देकर हीमोग्लोबिन में लौह से आक्सीजन के बंधन की मौलिक रसायनिक क्रिया को दर्शाया गया है.
रॉक बैंड प्लेसिबो ने ‘‘हीमोग्लोबिन’’ नामक एक गीत रिकार्ड किया है, जिसके बोल हैं,’’हीमोग्लोबिन स्वस्थ हृदयगति की कुंजी है’’.
इन्हें भी देखें
संपादित करें- साँचा:प्रोटियोपीडिया
- क्लोरोफिल
- ग्लोबिन गुना
- हेमोच्यानिं
- हेमोप्रोतें
- सिकल-सेल रोग
- पूर्ण रक्त-गणना
हीमोग्लोबिन वेरिएंट:
- एचबी 1C
- हीमोग्लोबिन A2
- हीमोग्लोबिन सी
- हीमोग्लोबिन एफ
सब यूनिटों प्रोटीन हीमोग्लोबिन (जीन):
- अल्फा ग्लोबिन 1
- बीटा ग्लोबिन 1
- डेल्टा ग्लोबिन
हीमोग्लोबिन यौगिकों:
- कार्बमिनोहेमोग्लोबिन (कार्बन डाइऑक्साइड के साथ रंग नीला)
- कार्बोक्सीहेमोग्लोबिन (कार्बन मोनोऑक्साइड के साथ चेरी(लाल) सा लाल रंग)
- ऑक्सीहेमोग्लोबिन (डायटोमिक ऑक्सीजन के साथ, रंग का खून से लाल)
सन्दर्भ
संपादित करें- ↑ Maton, Anthea (1993). Human Biology and Health. Englewood Cliffs, New Jersey, USA: Prentice Hall. आई॰ऍस॰बी॰ऍन॰ 0-13-981176-1. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद) - ↑ Costanzo, Linda S. (2007). Physiology. Hagerstwon, MD: Lippincott Williams & Wilkins. आई॰ऍस॰बी॰ऍन॰ 0-7817-7311-3.
- ↑ बिअगोली एम्, पिंटो एम्, केस्सेली डी, ज़निनेल्लो एम्, लाज़रेविक डी, रॉनकागलिया पी, सिमोने आर, वल्चौली सी, प्लेस्सी सी, बर्तीन एन, बेल्तार्मी ए, कोबायाशी के, गैल्लो वि, (2009). (अल्फा - बीटा) और (मसेंकेफलिक डॉपमिनेर्जिक) न्यूरॉन्स और ग्लिअल कोशिकाओं में ग्लोबिन का अप्रत्याशित अभिव्यक्ति.[मृत कड़ियाँ] प्रोक नटल एकाड विज्ञान अमेरिका 106:15454-15459. PMID 19717439 doi:10.1073/pnas.0813216106
- ↑ Hünefeld F.L. (1840). "Die Chemismus in der thierischen Organization". Leipzig. Cite journal requires
|journal=(मदद) - ↑ Funke O (1851). "Über das milzvenenblut". Z Rat Med. 1: 172–218.
- ↑ "A NASA Recipe For Protein Crystallography" (PDF). Educational Brief. National Aeronautics and Space Administration. मूल (PDF) से 10 अप्रैल 2008 को पुरालेखित. अभिगमन तिथि 2008-10-12.
- ↑ Hoppe-Seyler F (1866). "Über die oxydation in lebendem blute". Med-chem Untersuch Lab. 1: 133–140.
- ↑ Perutz, M.F.; Rossmann, M.G.; Cullis, A.F.; Muirhead, H.; Will, G.; North, A.C.T. (1960). "Structure of H". Nature. 185 (4711): 416–422. PMID 18990801. आइ॰एस॰एस॰एन॰ 0028-0836. डीओआइ:10.1038/185416a0.
- ↑ Perutz MF (1960). "Structure of haemoglobin". Brookhaven symposia in biology. 13: 165–83. PMID 13734651. आइ॰एस॰एस॰एन॰ 0068-2799. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ "मानव हीमोग्लोबिन वेरिएंट का एक पाठ्यक्रम (1996)". मूल से 1 सितंबर 2006 को पुरालेखित. अभिगमन तिथि 27 अगस्त 2010.
- ↑ "हीमोग्लोबिन वेरिएंट". मूल से 5 नवंबर 2006 को पुरालेखित. अभिगमन तिथि 27 अगस्त 2010.
- ↑ Uthman, MD, Ed. "Hemoglobinopathies and Thalassemias". मूल से 15 दिसंबर 2007 को पुरालेखित. अभिगमन तिथि 2007-12-26.
- ↑ रीड, लेस्ली. "अनुकूलन माउस जीन में पाया." ओमाहा विश्व हेराल्ड 11 अगस्त 2009: EBSCO. वेब. 30 अक्टूबर 2009.
- ↑ "Mammoths had ′anti-freeze′ blood". BBC. 2010-05-02. मूल से 4 मई 2010 को पुरालेखित. अभिगमन तिथि 2010-05-02.
- ↑ "Hemoglobin Synthesis". अप्रैल 14, 2002. मूल से 26 दिसंबर 2007 को पुरालेखित. अभिगमन तिथि 2007-12-26.
- ↑ अ आ वैन केस्सेल एट अल. "2.4 - प्राकृतिक प्रोटीन पोलीअमिडेस." 12 रसायन विज्ञान. टोरंटो: नेल्सन, 2003. 122. प्रिंट.
- ↑ "हीमोग्लोबिन ट्यूटोरियल." मैसाचुसेट्स के अम्हेर्स्ट विश्वविद्यालय. एनपी, एन डी वेब. 23 अक्टूबर 2009. <http://www.umass.edu/molvis/tutorials/hemoglobin/index.htm Archived 2009-11-26 at the वेबैक मशीन>.
- ↑ Steinberg 2001, पृष्ठ 95
- ↑ Hardison 1996, पृष्ठ 1
- ↑ "हीमोग्लोबिन." रसायन विज्ञान के स्कूल - ब्रिस्टल विश्वविद्यालय - ब्रिटेन. एनपी, एन डी. वेब. 12 अक्टूबर 2009. <http://www.chm.bris.ac.uk/motm/hemoglobin/hemoglobjm.htm Archived 2009-11-13 at the वेबैक मशीन>.
- ↑ विकीप्रेमेड > कोऑर्डिनेशन केमेस्ट्री Archived 2009-08-23 at the वेबैक मशीन 2 जुलाई 2009 को पुनःप्राप्त
- ↑ Linberg R, Conover CD, Shum KL, Shorr RG (1998). "Hemoglobin based oxygen carriers: how much methemoglobin is too much?". Artif Cells Blood Substit Immobil Biotechnol. 26 (2): 133–48. PMID 9564432. आइ॰एस॰एस॰एन॰ 1073-1199. डीओआइ:10.3109/10731199809119772. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Van Beekvelt MC, Colier WN, Wevers RA, Van Engelen BG (2001). "Performance of near-infrared spectroscopy in measuring local O2 consumption and blood flow in skeletal muscle" (Free full text). J Appl Physiol. 90 (2): 511–519. PMID 11160049. आइ॰एस॰एस॰एन॰ 8750-7587. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)[मृत कड़ियाँ] - ↑ "हीमोग्लोबिन." मेडीसीनेनेट. एनपी., एन डी. वेब. 12 अक्टूबर 2009. <www.medicinenet.com/hemoglobin/article.htm>.
- ↑ "हीमोग्लोबिन होम." जीवविज्ञान @ डेविडसन. एनपी, एन डी वेब. 12 अक्टूबर 2009. <http://www.bio.davidson.edu/Courses/Molbio/MolStudents/spring2005/Heiner/hemoglobin.html Archived 2009-12-01 at the वेबैक मशीन>.
- ↑ Baillie/Simpson. "Online model of the haemoglobin binding and the effects of hyperventilation". मूल से 31 अगस्त 2010 को पुरालेखित. अभिगमन तिथि 2006-08-10.
- ↑ Childs PE (2001). "Haemoglobin - a molecular lung: 2". Chemistry in Action (65). आइ॰एस॰एस॰एन॰ 0332-2637. मूल से 16 जनवरी 2009 को पुरालेखित. अभिगमन तिथि 27 अगस्त 2010.
- ↑ Chen H, Ikeda-Saito M, Shaik S (2008). "Nature of the Fe-O2 bonding in oxy-myoglobin: effect of the protein". Journal of the American Chemical Society. 130 (44): 14778–14790. PMID 18847206. डीओआइ:10.1021/ja805434m. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ हेमोग्लोबिन का निम्न-आवृत्ति वाला अनुकम्पन और सहकारिता. जैवरासायनिक विज्ञान में परिवर्तन, जैव रासायनिक विज्ञान, 14, 212 में रुझान.
- ↑ गाइटन: एसी चिकित्सा फिजियोलॉजी 11ed. 2005, पृष्ठ 509
- ↑ नेल्सन, डीएल, कॉक्स, (मिमी2000). लेहनिंगर प्रिंसिपल्स ऑफ़ बायोकैमिस्ट्री 3 एड. न्यूयॉर्क, एनवाई: वॉर्थ प्रकाशक. पृष्ठ 217
- ↑ Guyton, Arthur C. (2006). Textbook of Medical Physiology (11 संस्करण). Philadelphia: Elsevier Saunders. पृ॰ 511. आई॰ऍस॰बी॰ऍन॰ 0721602401. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद) - ↑ "यूट्यूब - व्याख्यान - 12 माईग्लोबिन और हीमोग्लोबिन." यूट्यूब- अपने आप को प्रसारण एनपी, एन डी वेब. 30 अक्टूबर 2009. <http://www.youtube.com/watch?v=6AfRX6oh9-E Archived 2012-04-18 at the वेबैक मशीन>.
- ↑ Rang, H.P. (2003). Pharmacology, Fifth Edition. Elsevier. आई॰ऍस॰बी॰ऍन॰ 0443072027. मूल से 2 अक्तूबर 2019 को पुरालेखित. अभिगमन तिथि 23 अक्तूबर 2019. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद) - ↑ विएस्टर एट अल. "रक्त में बेंजीन का विभाजन: मनुष्य और पशु में हीमोग्लोबिन प्रकार के प्रभाव." पर्यावरणीय स्वास्थ्य परिप्रेक्ष्य 110.3 (2002): p255-261. EBSCO. वेब. 1 नवम्बर 2009.
- ↑ "Hemoglobin Variants". Lab Tests Online. American Association for Clinical Chemistry. 2007-11-10. मूल से 5 नवंबर 2006 को पुरालेखित. अभिगमन तिथि 2008-10-12.
- ↑ Huisman THJ (1996). "A Syllabus of Human Hemoglobin Variants". Globin Gene Server. Pennsylvania State University. मूल से 1 सितंबर 2006 को पुरालेखित. अभिगमन तिथि 2008-10-12.
- ↑ Biology-Online.org --> Dictionary » H » Hypoxemia Archived 2009-11-21 at the वेबैक मशीन last modified 00:05, 29 दिसम्बर 2008
आगे पढ़ें
संपादित करें
|
|