लोहा
लोहा या लोह (Iron) आवर्त सारणी के आठवें समूह का पहला तत्व है। धरती के गर्भ में और बाहर मिलाकर यह सर्वाधिक प्राप्य तत्व है (भार के अनुसार)। धरती के गर्भ में यह चौथा सबसे अधिक पाया जाने वाला तत्व है। इसके चार स्थायी समस्थानिक मिलते हैं, जिनकी द्रव्यमान संख्या 54, 56, 57 और 58 है। लोह के चार रेडियोऐक्टिव समस्थानिक (द्रव्यमान संख्या 52, 53, 55 और 59) भी ज्ञात हैं, जो कृत्रिम रीति से बनाए गए हैं।
| लोहा / Iron रासायनिक तत्व | |
 | |
| रासायनिक चिन्ह: | Fe |
| परमाणु संख्या: | 26 |
| रासायनिक शृंखला: | संक्रमण धातु |
 आवर्त सारणी में स्थिति
| |
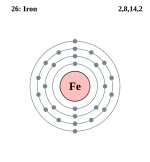 | |
| अन्य भाषाओं में नाम: | Iron (अंग्रेज़ी) |

लोहा एक मूलभूत सामग्री है जिसका लौह अयस्क से निष्कर्षण किया जाता है। शुद्ध लोहे का गलनांक 1530 डिग्री सेंटीग्रेड है और इसका घनत्व 7.86 ग्राम/सीसी है।[1]
लोहे का लैटिन नाम :- फेरस
इतिहास
संपादित करेंलौह धातु का पुरातन काल से मनुष्यों को ज्ञान है। भारत के लोगों को ईसा से 300-400 वर्ष पूर्व लोह के उपयोग ज्ञात थे। तमिलनाडु राज्य के तिन्नवेली जनपद में, कर्णाटक के ब्रह्मगिरी तथा तक्षशिला में पुरातत्व काल के लोहे के हथियार आदि प्राप्त हुए हैं, जो लगभग 400 वर्ष ईस्वी के पूर्व के ज्ञात होते हैं। कपिलवस्तु, बुद्धगया आदि में आज से 1,500 वर्ष पहले भी लोग लोहे के उद्योग में निपुण थे, क्योंकि इन स्थानों में लौह धातुकर्म के अनेक चिह्र आज भी प्राप्त हैं। दिल्ली की कुतुबमीनार के सामने लोहे का विशाल स्तंभ चौथी शताब्दी में पुष्कर्ण, राजस्थान के राजा चंद्रवर्मन, के काल में बना था। यह भारत के उत्कृष्ट धातुशिल्प का ज्वलंत उदाहरण है। इस स्तंभ की लंबाई 24 फुट और अनुमानित भार 6 टन से अधिक है। इसके लोहे के विश्लेषण से ज्ञात हुआ है कि इसमें 99.72 प्रतिशत लोहा है। चौथी शताब्दी की धातुकर्मकला का अनुमान इसी से हो सकता है कि 15 शताब्दियों से यह स्तंभ वायु और वर्षा के बीच अप्रभावित खड़ा है। आश्चर्य की बात तो यह है कि इतना लंबा चौड़ा स्तंभ किस प्रकार बनाया गया, क्योंकि आज भी इतना विशाल दंड बनाना कठिन कार्य है।
भारत में इस्पात उद्योग की परंपरा भी बहुत प्राचीन है। ऐतिहासिक लेखों से ज्ञात होता है कि ईसा से 5 शताब्दी पूर्व भारत की इस्पात की तलवारें ईरान आदि देशों में बहुत विख्यात थीं। भारत से लोहा और इस्पात आज से 2,000 वर्ष पूर्व यूरोप तथा ऐबिसिनिया (अफ्रीका) में भेजा जाता था। सम्राट् अशोक के काल में इस्पात के उपकरण अनेक विशेष कार्यों में प्रयुक्त होते थे। ईरानियों तथा अरबों ने इस्पात पर पानी चढ़ाने (tempering) की कला को भारत से ही सीखा। चरक के समय में लोहे का औषधि के रूप में भी उपयोग होता था। उस समय दो प्रकार के लोहे का वर्णन आया है : कालायस् और तीक्षायस्, अर्थात् लौह चूर्ण तथा मोरचा (rust)। मोरचे का प्रयोग रक्तक्षीणता (anaemia) के उपचार में होता था। अश्म कसीस या फेरस सल्फेट (ferrous sulphate) तथा माक्षिक (pyrites) का उपयोग अनेक रोगों (जैसे-दाद या पामा, कुष्ठ, योनिरोग आदि) में बताया गया है।
लोह का उपयोग कुछ अन्य देशों में भी प्राचीन काल से ज्ञात है। प्राचीन मिस्र, ऐसीरिया, यूनान तथा रोम में लोग लोहे का उपयोग करते थे। यूरोप की सर्वप्रथम वात भट्ठी सन् 1350 में जर्मनी में बनी थी। अठारहवीं शताब्दी में कोक (coke) का उपयोग प्रारंभ होने से लोहे के उद्योग में बहुत वृद्धि हुई। उन्नीसवीं शताब्दी में इस्पात बनाने की दो मुख्य विधियाँ, बेसेमर तथा सीमेंस मार्टिन प्रक्रम, निकाली गई।
उपस्थिति एवं प्राप्ति
संपादित करेंपृथ्वी का क्रोड (core) लोह धातु का बना है, परंतु ऊपरी सतह पर दूसरे तत्वों द्वारा अभिक्रिया के फलस्वरूप लोह के यौगिक ही मिलते हैं। पृथ्वी की ऊपरी सतह पर लोह के यौगिक प्रचुर मात्रा में उपस्थित हैं। इनकी मात्रा अन्य तत्वों की तुलना में चौथे स्थान पर है। लोह दो मुख्य रूपों में पाया जाता है : मैग्नेटाइट, लो3औ4 (Fe3O4)। और हेमाटाइट लो2 औ3 (Fe2O3)। मैग्नेटाइट काला क्रिस्टलीय खनिज पदार्थ है, जिसमें तीव्र चुंबकीय गुण होते हैं। हेमाटाइट प्राय: जल द्वारा हाइड्रेट लिमोनाइट, लो2 औ3. हा2 औ (Fe2O3 H2O) बनने के कारण क्रिस्टलीय रूप में कम मिलता है। शुद्ध हेमाटाइट के क्रिस्टल गहरे भूरे, या काले रंग के होते हैं। जिनमें लाल धारियाँ पड़ी रहती हैं। इसमें निर्बल चुंबकीय गुण होते हैं। प्राय: लोह के अयस्क में यह दोनों रूप विभिन्न मात्रा में वर्तमान रहते है। कुछ अयस्कों में फेरस कार्बेनिट भी उपस्थित रहता है। कभी-कभी लोह माक्षिक के रूप में भी पाया जाता है, जो फेरस सल्फाइड है। इसको जलाने पर फेरो फेरिक या फेरिक ऑक्साइड, (Fe3O4 या Fe2O3) बचता है तथा सल्फर डाइऑक्साइड मुक्त हो जाता है।
भारत में झारखण्ड (सिंहभूम), छत्तीसगढ़ (दुर्ग), उड़ीसा (मयूरभंज) तथा मैसूर (चमुंडी) में लोहे की मुख्य खानें है।
लोहे के अयस्क लगभग सब क्षेत्रों में पाए जाते हैं। ब्रिटेन में यार्कशिर और उत्तरी मिडलैंड में, जर्मनी के उत्तरी समुद्री किनारे पर तथा स्वीडन में लोहे के उत्तम अयस्क है। उत्तरी अमरीका के सुपीरियर झील के क्षेत्र पर अमरीका का विशाल इस्पात उद्योग निर्भर करता है।
लौह अयस्क: प्राकृतिक रूप में निकलने वाला एक खनिज है जिसमें से आयरन (एफई) धातु का निष्कर्षण विभिन्न रूपों अर्थात हॉट मेटल/डीआरआई आदि में किया जाता है।[2]
निर्माण
संपादित करेंलोह अयस्क को सर्वप्रथम भूनकर (roast) जल वाष्प आदि दूर करते हैं तथा कार्बोनेट एवं सल्फाइड का ऑक्सीकरण कर देते हैं। इस अयस्क का अपचयन कोक द्वारा एक भट्ठी में करते हैं, जिसे वात्य भट्ठी कहते हैं। अयस्क को कैल्सियम कार्बोनेट अथवा मैग्नीशियम कार्बोनेट, सिलिका तथा कोक के साथ मिलाकर, भट्ठी के ऊपरी छिद्र से, भट्ठी में प्रवेश करते हैं। नीचे के छिद्रों से गरम वायु को ऊपर की ओर प्रवाहित किया जाता है। अंदर की प्रक्रिया द्वारा गैस बाहर निकलती है और द्रव लोह तथा धातुमल (slag) जमा हो जाते हैं, जिन्हें समय समय पर निकाला जा सकता है। भट्ठी में होनेवाली मुख्य प्रक्रियाएँ निम्न समीकरणों द्वारा प्रदर्शित की जा सकती हैं :
2 C + O2 = 2 CO
3 CO + Fe2O3 = 2Fe + 3 CO2
CaCO3 = CaO + CO2
CaO + SiO2 = CaSio3 (slag)
प्राप्त लोहे द्वारा ढलवाँ लोहा, या इस्पात (steel) तैयार कर सकते है। इस्पात बनाने के दो मुख्य तरीके हैं, एक बेसेमर विधि (Bessemer Process) और दूसरा सीमेंज़-मर्टिन की ओपेन हार्थ विधि (Siemen Martins-Open Hearth Process)
ये सब लोह के शुद्ध रूप नहीं हैं। इमें कार्बन तथा अन्य अपद्रव्य सर्वदा मिले रहते हैं। उच्च ताप के लोह ऑक्साइड पर हाइड्रोजन प्रवाहित करने से शुद्ध लोहा प्राप्त हो सकता है। लोह लवण के विद्युत् अपघटन द्वारा भी शुद्ध धातु मिलेगी।
गुणधर्म
संपादित करेंलोहा श्वेत रंग की धातु है, जो नमी अथवा जल से शीघ्रता से मलीन हो जाती है। यह कोमल, आघातवर्ध्य और तन्य धातु है, जिसमें तीव्र चुंबकीय गुण वर्तमान है। इसके अपररूप ज्ञात हैं। साधारण ताप पर लोहा ऐल्फा रूप (a form) में रहता है। 768 डिग्री सें. पर यह बीटा रूप (b form) में बदल जाता है, जिसमें चुंबकीय गुण नहीं रहते। 906 डिग्री सें. पर यह गामा (g) रूप में परिणत हो जाता है, जिसकी क्रिस्टलीय सरंचना सामान्य रूप से भिन्न है। तत्पश्चात् 1401 डिग्री सें. पर लोहा फिर ऐल्फा रूप पर आ जाता है। लोहे के कुछ भौतिक नियतांक निम्नांकित हैं :
संकेत लो (Fe), परमाणु संख्या 26,
परमाणु भार 550.85,
गलनांक 1539 डिग्री सें.,
क्वथनांक 2740 डिग्री सें.,
घनत्व 7.86 ग्रा. प्रति घन सेमी.,
विद्युत् प्रतिरोधकता 9.71 माइक्रोओम-सेंमी.,
परमाणु व्यास 2.52 ऐंग्स्ट्राम तथा
आयनन विभव 7.868 एलेक्त्रॉन वोल्ट
लोहे के रासायनिक गुण निकल तथा कोबाल्ट से मिलते जुलते हैं। यह सक्रिय तत्व है और ऑक्सीजन में जलने पर फेरसफेरिक ऑक्साइड बनाता है। लोह तनु अम्ल विलयनों हाइड्रोजन मुक्त करता है, परंतु अत्यंत सांद्र नाइट्रिक अम्ल में डालने पर यह निष्क्रिय हो जाता है। इसके पश्चात् यह तनु अम्लों से अभिक्रिया नहीं करता। निष्क्रियता का गुण धातु पर ऑक्साइड के हल्के स्तर बनने के कारण आ जाता है। यदि निष्क्रिय धातु पर वेग से चोट की जाए, तो चोट लगने के स्थान पर ऑक्साइड की परत टूट जाएगी और उस स्थान से क्रिया प्रारंभ होकर सारी धातु को सक्रिय बना देगी। लोहा अपचायक धातु है और स्वर्ण, प्लैटिनम, रजत, पारद, ताम्र आदि के आयनों का अपयचन कर धातु में परिणत कर देता है। लोहा अनेक अधातु तत्वों से क्रिया कर यौगिक बनाता है।
उच्च ताप का जलवाष्प (570 डिग्री सें.), लोहे द्वारा विघटित होकर, फेरोफेरिक ऑक्साइड, (Fe3 O4), बनाता है और हाइड्रोजन मुक्त होता है। उच्च ताप पर अमोनिया लोहे से अभिक्रिया कर लोह नाइट्राइड, (Fe2 N), बनाता है।
लोहा मुख्यत: दो और तीन संयोजकता के यौगिक बनाता है। दो संयोजकता के फेरस, (Fe++), आयन का विलयन हल्के हरे रंग का है। वायु के ऑक्सीजन द्वारा उसका ऑक्सीकरण हो जाता है। तीन संयोजकता के फेरिक, (Fe+++), आयन का अम्लीय विलयन पीले रंग का रहता है। फेरस तथा फेरिक दोनों आयन अनेक जटिल यौगिक बनाते हैं। इनके अतिरिक्त इनके अनेक चिलेट (chelate) यौगिक भी ज्ञात हैं।
लोह के चार संयोजकता के परफैराइट, (Fe O3- -) और छह संयोजकता के फेरेट, (Fe O4- -) यौगिक भी ज्ञात हैं। ये क्षारीय अवस्था में प्रबल ऑक्सीकारकों द्वारा बनते हैं। ये अस्थायी यौगिक हैं और बहुत कम मात्रा में बनाए जा सकते हैं।
यौगिक
संपादित करेंलोहे के तीन ऑक्साइड ज्ञात हैं : फेरस ऑक्साइड लो औ (Fe O), फेरिक ऑक्साइड, लो2 औ3 (Fe2 O3) और फेरोफेरिक ऑक्साइड, (Fe3 O4)। फेरस यौगिक में क्षार डालने पर फेरस हाइड्रॉक्साइड, [ Fe (OH)2], का श्वेत अवक्षेप प्राप्त होता है। यह वायु में शीघ्र आक्सीकृत हो भूरे फेरिक ऑक्साइड में परिणत होता है। फेरिक यौगिक में क्षार डालने पर भूरा अवक्षेप प्राप्त होता है, जो जलयोजित (hydrated) फेरिक ऑक्साइड कहलाता है। यदि फेरस विलयन में कार्बोनेट विलयन मिश्रित किया जाए, तो फेरस कार्बोनेट का श्वेत अवक्षेप प्राप्त होता है। वायु में रखने पर यह शीघ्र ही फेरिक अवस्था में परिणत हो जाता है। शुद्ध फेरिक कार्बोनेट ज्ञात नहीं है।
लोहे के अनेक नाइट्राइड ज्ञात हैं। लोहे को अमोनिया के साथ उच्च ताप पर रखने से लौह नाइट्राइड, (Fe2 N) बनता है। इसके अतिरिक्त दो और नाइट्राइड, (Fe3 N2) और (Fe N) भी विशेष अभिक्रियाओं द्वारा बनाए गए हैं। "नाइट्रिक अम्ल के साथ दो लवण फेरस नाइट्रेट, Fe (NO3)2. 6H2O] और फेरिक नाइट्रेट, [ Fe (NO3)3. 6 H2 O, and Fe (N O3)3 9 H2O] बनते हैं। फेरस नाइट्रेट अस्थायी यौगिक है।
फ़ॉस्फ़ोरस से अभिक्रिया कराकर लोहे के चार फ़ॉस्फ़ाइड बनाए गए हैं, (Fe3 P), (Fe2 P), (FeP) तथा (Fe2 P3)। इनके अतिरिक्त फेरस फ़ॉस्फेट, Fe3 (PO4)2 8H2.O] और फेरिक फ़ॉस्फ़ेट, (Fe PO4), भी निर्मित हुए हैं।
लोहे और सल्फर की अभिक्रिया द्वारा दो यौगिक बनते हैं, एक फेरस सल्फाइड, (Fe S) और दूसरा फेरस डाइसल्फाइड, (Fe S2)। यह ध्यान देने योग्य है कि दोनों यौगिकों में लौह की संयोजकता दो है। दूसरी अभिक्रियाओं द्वारा फेरिक सल्फाइड, (Fe2 S3), भी बनाया गया है।
लौह को सल्फ्यूरिक अम्ल, (H2 SO4), में घुलाने पर फेरस सल्फेट, (Fe SO4. 7 H2O), बनता है। इसमें तप्त नाइट्रिक अम्ल डालने पर यह फेरिक सल्फेट, [ Fe2 (SO4)3] में परिणत हो जाता है।
यदि हाइड्रोजन क्लोराइड, (HCl), के वातावरण में लोहे को तप्त किया जाए, तो श्वेत फेरस क्लोराइड, (FeCl2) बनता है। लौह कार्बोनेट पर हाइड्रोक्लोरिक अम्ल की क्रिया द्वारा हल्के हरे रंग का हाइड्रेट (hydrate), (Fe Cl2 .4H2 O) बनता है। परंतु रक्त तप्त लोहे पर क्लोरीन प्रवाहित करने पर गहरे हरे रंग का ठोस फेरिक क्लोराइड बनता है। यह यौगिक सुलभ, (Fe Cl3) न होकर द्विलक, (Fe2 Cl6) के रूप में प्राप्त होता है। यह शीघ्र वाष्प का अवशोषण कर (FeCl3.6H2O) हाइड्रेट बन जाता है। लोहे के अन्य हैलोजन तत्वों के साथ दो और तीन संयोजकता के यौगिक भी बनते हैं।
लौह चूर्ण कार्बन मॉनॉक्साइड, (CO), से क्रिया कर लोह कार्बोनिल यौगिक बनाता है। यह उच्च ताप और दबाव पर अधिक मात्रा में बनता है। लोह पॅटाकार्बोनिल, [ Fe (CO)5], पीला पदार्थ है। इसके अतिरिक्त दो और कार्बोनिल, [Fe2 (CO)9] और [ Fe3 (CO)12], भी ज्ञात है। इन यौगिकों में प्रत्येक अंश सवर्ग बंध (coordinate bonds) द्वारा लोहे से जुड़े रहते हैं। इसी प्रकार के नाइट्रोसिल यौगिक, [ Fe (NO)4] और मिश्रित कार्बोनिल नाइट्रोसिल, [ Fe (NO)2, (CO)2], भी ज्ञात हैं।
लोहे के जटिल यौगिकों (complex compounds) में साइआनाइड यौगिकों का विशेष स्थान है। यदि किसी फेरस या फेरिक लवण के विलयन में कोई साइआनाइड विलयन डाला जाय, तो सर्वप्रथम क्रमश: [ Fe (CN)2] और [ Fe (CN)3] के अवक्षेप प्राप्त होंगे, परंतु अधिक साइआनाइड डालने पर वे फिर विलीन हो जाएँगे। इन विलयन में क्रमश: फेरोसाइआनाइड (Ferrocyanide), [ Fe (CN)64-] और फेरिसाइआनाइड (Ferricyanide), [ Fe (CN)63-], उपस्थित रहते हैं। यदि केरिसाइआनाइड में फेरस, (Fe++), आयन मिलाएँ, अथवा फेरोसाइआनाइड में फेरिक, (Fe+++), आयन मिलाएँ, तो क्रमश: गहरे नीले रंग के प्रशियन ब्लू (Prussian blue) और टर्नबुल ब्लू (Turnbull's blue) रंजक प्राप्त होते हैं।
शारीरिक क्रिया में लोहे का स्थान
संपादित करेंलोहा शरीर के लिए आवश्यक तत्व है। रक्त की लाल कोशिकाओं (red cells), हीमोग्लोबिन, का यह आवश्यक अंग है। साथ साथ यकृत, प्लीहा और मेरुदंड में यह जमा रहता है, ताकि आवश्यकता पड़ने पर यह हीमोग्लोबिन बनाने के काम आ सके। इनके अतिरिक्त मांसपेशियों में भी यह उपस्थित रहता है। लोह मूलत: हीमोग्लोबिन (C34H33N4O4FeOH), के हीम (haem) में फेरस, (Fe++), स्थिति में रहता है, परंतु यह अणु ऑक्सीजन से क्रिया कर ऑक्सीहीमोग्लोबिन बनाता है, जिसके द्वारा एक ऑक्सीजन अणु एक हीमोग्लोबिन अणु से संयुक्त हो जाता है। परंतु दाब कम होने पर यह ऑक्सीजन अणु पुन: मुक्त हो सकता है। इस प्रकार हीमोग्लोबिन अणु शरीर में ऑक्सीजन वाहक का कार्य करता है, जो आवश्यकतानुसार ऑक्सीजन ग्रहण, या मुक्त करता है। शरीर में लोहे की मात्रा कम होने पर अनेक लौह यौगिक ओषधि के रूप में दिए जाते हैं।
उत्पादन
संपादित करें-
लोहा के अयस्क छर इस्पात में संसाधित होने वाली है
-
Iron production at Coalbrookdale, Shropshire (by Philipp Jakob Loutherbourg, 1801)
-
19वीं सदी में लोहे का उत्पादन ऐसे होता था।
-
[[डेट्रॉइट]], [[मिशिगन]], [[यूएसए]] में वेन स्टेट यूनिवर्सिटी के एक फाउंड्री में हाथ से बने कपल से लोहा डालते हुए छात्र
उपयोग
संपादित करें-
Iron axe from Sweden
-
cast-iron stove plate
-
Iron bridge
-
Italy/Venice
Ornamental grating
विविध
संपादित करें-
Iron oxide
-
The Iron Pillar in Delhi.
-
Alchemical symbol
-
Iron Oxide staining
-
Iron recycling
-
Hydroxid železnatý - Fe(OH)2
-
Uhličitan železitý - Fe2(CO3)3
-
Fosforečnan železnatý - Fe3(PO4)2
-
Oxid železitý - Fe2O3
इन्हें भी देखें
संपादित करें- कच्चा लोहा (Pig iron)
- ढलवां लोहा (cast iron)
- इस्पात (steel)
- एल्युमिनियम
- ↑ "Iron Steel Industry". मूल से 23 मई 2024 को पुरालेखित. अभिगमन तिथि 1 अक्तूबर 2024.
- ↑ "Iron Steel Industry". मूल से 23 मई 2024 को पुरालेखित. अभिगमन तिथि 1 अक्तूबर 2024.