कोरकभवन
ब्लास्टुलेशन प्रारंभिक पशु भ्रूण विकास का वह चरण है जो ब्लास्टुला का निर्माण करता है। स्तनधारी विकास में ब्लास्टुला एक विभेदित आंतरिक कोशिका द्रव्यमान और एक बाहरी ट्रोफेक्टोडर्म के साथ ब्लास्टोसिस्ट में विकसित होता है। ब्लास्टुला (ग्रीक βλαστός (ब्लास्टोस का अर्थ है अंकुर) से) कोशिकाओं का एक खोखला गोला है, जिसे ब्लास्टोमेरेस के रूप में जाना जाता है, जो ब्लास्टोकोल नामक आंतरिक द्रव से भरी गुहा के आसपास होता है।[1][2] भ्रूण का विकास एक शुक्राणु द्वारा अण्डाणु की कोशिका को निषेचित करके युग्मनज बनने से शुरू होता है, जो मोरूला नामक कोशिकाओं की एक गेंद में विकसित होने के लिए कई दरारों से गुजरता है। केवल जब ब्लास्टोकोल बनता है तो प्रारंभिक भ्रूण ब्लास्टुला बन जाता है। ब्लास्टुला गैस्ट्रुला के निर्माण से पहले होता है जिसमें भ्रूण की रोगाणु परतें बनती हैं।[3]
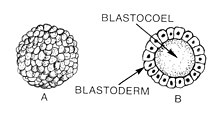
कशेरुकी ब्लास्टुला की एक सामान्य विशेषता यह है कि इसमें ब्लास्टोमेरेस की एक परत होती है, जिसे ब्लास्टोडर्म के रूप में जाना जाता है, जो ब्लास्टोसील को घेरता है।[4][5] स्तनधारियों में, ब्लास्टोसिस्ट में एक एम्ब्रियोब्लास्ट (या आंतरिक कोशिका द्रव्यमान) होता है जो अंततः भ्रूण की निश्चित संरचनाओं को जन्म देगा, और एक ट्रोफोब्लास्ट जो अतिरिक्त-भ्रूण ऊतकों का निर्माण करता है।[3][6]
ब्लास्टुलेशन के दौरान, प्रारंभिक भ्रूण के भीतर कोशिका ध्रुवता, कोशिका विशिष्टता, अक्ष गठन स्थापित करने और जीन अभिव्यक्ति को विनियमित करने के लिए महत्वपूर्ण मात्रा में गतिविधि होती है।[7] ड्रोसोफिला और ज़ेनोपस जैसे कई जानवरों में, मध्य ब्लास्टुला संक्रमण (एमबीटी) विकास में एक महत्वपूर्ण चरण है, जिसके दौरान मातृ एमआरएनए का क्षरण होता है और विकास पर नियंत्रण भ्रूण को दिया जाता है।[8] ब्लास्टोमेरेस के बीच कई अंतःक्रियाएं कैडेरिन अभिव्यक्ति पर निर्भर होती हैं, विशेष रूप से स्तनधारियों में ई-कैडरिन और उभयचरों में ईपी-कैडरिन।[7]
ब्लास्टुला और सेल विशिष्टता के अध्ययन से स्टेम सेल अनुसंधान और सहायक प्रजनन तकनीक में कई निहितार्थ हैं।[6] ज़ेनोपस में, ब्लास्टोमेरेस प्लुरिपोटेंट स्टेम कोशिकाओं के रूप में व्यवहार करते हैं जो सेल सिग्नलिंग के आधार पर कई मार्गों से पलायन कर सकते हैं।[9] विकास के ब्लास्टुला चरण के दौरान कोशिका संकेतों में हेरफेर करके, विभिन्न ऊतकों का निर्माण किया जा सकता है। यह क्षमता रोग और चोट के मामलों के लिए पुनर्योजी चिकित्सा में सहायक हो सकती है। इन विट्रो फर्टिलाइजेशन में भ्रूण को आरोपण के लिए गर्भाशय में स्थानांतरित करना शामिल है।[10]
विकास
संपादित करेंप्रारंभिक भ्रूण विकास की ब्लास्टुला अवस्था ब्लास्टोसील के प्रकट होने के साथ शुरू होती है। ज़ेनोपस में ब्लास्टोसील की उत्पत्ति पहले दरार फ़रो से दिखाई गई है, जिसे एक गुहा बनाने के लिए तंग जंक्शनों के साथ चौड़ा और सील किया जाता है।[11]
कई जीवों में भ्रूण का विकास इस बिंदु तक और ब्लास्टुला चरण के शुरुआती भाग के लिए मातृ mRNA द्वारा नियंत्रित होता है, जिसे इसलिए कहा जाता है क्योंकि यह निषेचन से पहले अंडे में उत्पन्न होता है और इसलिए विशेष रूप से माँ से होता है।[12][13]
मिडब्लास्टुला संक्रमण
संपादित करेंज़ेनोपस और ड्रोसोफिला सहित कई जीवों में, मिडब्लास्टुला संक्रमण आमतौर पर किसी दी गई प्रजाति के लिए एक विशेष संख्या में कोशिका विभाजन के बाद होता है, और इसे प्रारंभिक ब्लास्टुला विकास के तुल्यकालिक कोशिका विभाजन चक्र के अंत और कोशिका चक्रों के बढ़ने से परिभाषित किया जाता है।[13] G1 और G2 चरणों को जोड़कर। इस संक्रमण से पहले, कोशिका चक्र के केवल संश्लेषण और माइटोसिस चरणों के साथ दरार होती है। कोशिका चक्र में दो विकास चरणों को जोड़ने से कोशिकाओं के आकार में वृद्धि होती है, क्योंकि इस बिंदु तक ब्लास्टोमेरेस रिडक्टिव डिवीजनों से गुजरते हैं जिसमें भ्रूण का समग्र आकार नहीं बढ़ता है, लेकिन अधिक कोशिकाएं बनती हैं। यह संक्रमण जीव के आकार में वृद्धि शुरू करता है।[3]
मध्य-ब्लास्टुला संक्रमण की विशेषता जीव के जीनोम से प्रतिलेखित नए, गैर-मातृ mRNA के प्रतिलेखन में उल्लेखनीय वृद्धि से भी होती है। इस बिंदु पर मातृ mRNA की बड़ी मात्रा नष्ट हो जाती है, या तो ड्रोसोफिला में SMAUG जैसे प्रोटीन द्वारा[14] या माइक्रोआरएनए द्वारा।[15] ये दोनों प्रक्रियाएं भ्रूण का नियंत्रण मातृ mRNA से नाभिका की ओर स्थानांतरित कर देती हैं।
संरचना
संपादित करेंब्लास्टुला ( स्तनधारियों में ब्लास्टोसिस्ट ), कोशिकाओं का एक गोला होता है जो द्रव से भरी गुहा को घेरता है जिसे ब्लास्टोसील कहते हैं। ब्लास्टोसील में अमीनो एसिड, प्रोटीन, वृद्धि कारक, शर्करा, आयन और अन्य घटक होते हैं जो कोशिकीय विभेदन के लिए आवश्यक होते हैं। ब्लास्टोसील गैस्ट्रुलेशन की प्रक्रिया के दौरान ब्लास्टोमेरेस को भी स्थानांतरित करने की अनुमति देता है।[16]
ज़ेनोपस भ्रूण में, ब्लास्टुला तीन अलग-अलग क्षेत्रों से बना होता है। पशु टोपी ब्लास्टोसील की छत बनाती है और मुख्य रूप से एक्टोडर्मल व्युत्पन्नों का निर्माण करती है। भूमध्यरेखीय या सीमांत क्षेत्र, जो ब्लास्टोसील की दीवारों का निर्माण करता है, मुख्य रूप से मेसोडर्मल ऊतक में विभेदित होता है। वनस्पति द्रव्यमान ब्लास्टोसील तल से बना होता है और मुख्य रूप से एंडोडर्मल ऊतक में विकसित होता है।[7]
स्तनधारी ब्लास्टोसिस्ट में, तीन वंशावली जो बाद में ऊतक विकास को जन्म देती हैं। एपिब्लास्ट स्वयं भ्रूण को जन्म देता है जबकि ट्रोफोब्लास्ट प्लेसेंटा के हिस्से में विकसित होता है और आदिम एंडोडर्म जर्दी थैली बन जाता है।[6] चूहे के भ्रूण में, ब्लास्टोकोल का निर्माण 32-कोशिका चरण में शुरू होता है। इस प्रक्रिया के दौरान, पानी एक ऑस्मोटिक ग्रेडिएंट की सहायता से भ्रूण में प्रवेश करता है, जो सोडियम-पोटेशियम पंपों का परिणाम है जो ट्रोफेक्टोडर्म के बेसोलैटरल पक्ष पर एक उच्च सोडियम ग्रेडिएंट उत्पन्न करता है। पानी की इस गति को एक्वापोरिन द्वारा सुगम बनाया जाता है। ब्लास्टोकोल की रेखा बनाने वाली उपकला कोशिकाओं के तंग जंक्शनों द्वारा एक सील बनाई जाती है।[6]
कोशिकीय आसंजन
संपादित करेंभ्रूण के विकास में तंग जंक्शन बहुत महत्वपूर्ण हैं। ब्लास्टुला में, ये कैडेरिन-मध्यस्थ सेल इंटरैक्शन एपिथेलियम के विकास के लिए आवश्यक हैं जो पैरासेल्यूलर परिवहन, सेल ध्रुवीयता के रखरखाव और ब्लास्टोकोल गठन को विनियमित करने के लिए पारगम्यता सील के निर्माण के लिए सबसे महत्वपूर्ण है। ये तंग जंक्शन उपकला कोशिकाओं की ध्रुवता स्थापित होने के बाद उत्पन्न होते हैं जो आगे के विकास और विशिष्टता के लिए नींव तैयार करते हैं। ब्लास्टुला के भीतर, आंतरिक ब्लास्टोमेर आम तौर पर गैर-ध्रुवीय होते हैं जबकि उपकला कोशिकाएं ध्रुवीयता प्रदर्शित करती हैं।[16]
स्तनधारी भ्रूण 8-कोशिका चरण के आसपास संघनन से गुजरते हैं जहां ई-कैडरिन के साथ-साथ अल्फा और बीटा कैटेनिन भी व्यक्त होते हैं। यह प्रक्रिया फैलती और अविभाजित कोशिकाओं के समूह के बजाय भ्रूण कोशिकाओं की एक गेंद बनाती है जो बातचीत करने में सक्षम होती है। ई-कैडरिन आसंजन विकासशील भ्रूण में एपिको-बेसल अक्ष को परिभाषित करता है और भ्रूण को कोशिकाओं की एक अस्पष्ट गेंद से अधिक ध्रुवीकृत फेनोटाइप में बदल देता है जो पूरी तरह से गठित ब्लास्टोसिस्ट में आगे के विकास के लिए चरण निर्धारित करता है।[16]
ज़ेनोपस झिल्ली ध्रुवता प्रथम कोशिका विभाजन के साथ स्थापित होती है। उभयचर ईपी-कैडेरिन और एक्सबी/यू कैडहेरिन स्तनधारियों में ब्लास्टोमेयर ध्रुवता स्थापित करने और कोशिका-कोशिका अंतःक्रियाओं को ठोस बनाने में ई-कैडहेरिन के समान भूमिका निभाते हैं जो आगे के विकास के लिए महत्वपूर्ण हैं।[16]
क्लीनिकल उलझाव
संपादित करेंनिषेचन प्रौद्योगिकियां
संपादित करेंचूहों में प्रत्यारोपण के प्रयोगों से पता चलता है कि हार्मोनल प्रेरण, सुपरओव्यूलेशन और कृत्रिम गर्भाधान से प्रत्यारोपण-पूर्व चूहे भ्रूण का सफलतापूर्वक उत्पादन होता है। चूहों में, नब्बे प्रतिशत मादाओं को गर्भधारण करने और कम से कम एक भ्रूण प्रत्यारोपित करने के लिए यांत्रिक उत्तेजना द्वारा प्रेरित किया गया। [17] ये परिणाम उत्साहवर्धक हैं, क्योंकि ये अन्य स्तनधारी प्रजातियों, जैसे कि मानव, में संभावित प्रत्यारोपण के लिए आधार प्रदान करते हैं।
मूल कोशिका
संपादित करेंब्लास्टुला-चरण कोशिकाएं कई प्रजातियों में बहुक्षम स्टेम कोशिकाओं के रूप में व्यवहार कर सकती हैं। बहुक्षमता वाले स्टेम कोशिकाएं अंग-विशिष्ट कोशिकाओं के उत्पादन के लिए प्रारंभिक बिंदु हैं, जो संभावित रूप से चोट और अध:पतन की मरम्मत और रोकथाम में सहायता कर सकती हैं। प्रतिलेखन कारकों की अभिव्यक्ति और ब्लास्टुला कोशिकाओं की स्थानीय स्थिति के संयोजन से प्रेरित कार्यात्मक अंगों और ऊतकों का विकास हो सकता है। प्लुरिपोटेंट ज़ेनोपस कोशिकाएं, जब इन विवो रणनीति में उपयोग की गईं, तो कार्यात्मक रेटिना बनाने में सक्षम थीं। उन्हें तंत्रिका प्लेट पर आंख के क्षेत्र में प्रत्यारोपित करके, और प्रतिलेखन कारकों के कई गलत अभिव्यक्तियों को प्रेरित करके, कोशिकाओं को रेटिना वंश के लिए प्रतिबद्ध किया गया और वे ज़ेनोपस में दृष्टि आधारित व्यवहार का मार्गदर्शन कर सकते थे।[18]
संदर्भ
संपादित करें- ↑ "Blastulation". web-books.com. मूल से 29 अक्तूबर 2021 को पुरालेखित. अभिगमन तिथि 1 जुलाई 2024.
- ↑ "Blastula". Encyclopædia Britannica। (2013)।
- ↑ अ आ इ Gilbert, Scott (2010). Developmental Biology 9th Ed + Devbio Labortatory Vade Mecum3. Sinauer Associates Inc. पपृ॰ 243–247, 161. आई॰ऍस॰बी॰ऍन॰ 978-0-87893-558-1.
- ↑ Lombardi, Julian (1998). "Embryogenesis". Comparative vertebrate reproduction. Springer. पृ॰ 226. आई॰ऍस॰बी॰ऍन॰ 978-0-7923-8336-9.
- ↑ Forgács & Newman, 2005: p. 27
- ↑ अ आ इ ई Cockburn, Katie; Rossant, Janet (1 April 2010). "Making the blastocyst: lessons from the mouse". Journal of Clinical Investigation. 120 (4): 995–1003. PMID 20364097. डीओआइ:10.1172/JCI41229. पी॰एम॰सी॰ 2846056.
- ↑ अ आ इ Heasman, J (November 1997). "Patterning the Xenopus blastula". Development. 124 (21): 4179–91. PMID 9334267. डीओआइ:10.1242/dev.124.21.4179.
- ↑ Tadros, Wael; Lipshitz, Howard D. (1 March 2004). "Setting the stage for development: mRNA translation and stability during oocyte maturation and egg activation in Drosophila". Developmental Dynamics. 232 (3): 593–608. PMID 15704150. डीओआइ:10.1002/dvdy.20297.
- ↑ Gourdon, John B.; Standley, Henrietta J. (December 2002). "Uncommitted Xenopus blastula cells can be directed to uniform muscle gene expression by gradient interpretation and a community effect". The International Journal of Developmental Biology (Cambridge, UK). 46 (8): 993–8. PMID 12533022.
- ↑ Toth, Attila. "Treatment: Addressing the Causes of Infertility in Men and Women". Macleod Laboratory. अभिगमन तिथि 22 March 2013.
- ↑ Kalt, MR (August 1971). "The relationship between cleavage and blastocoel formation in Xenopus laevis. I. Light microscopic observations". Journal of Embryology and Experimental Morphology. 26 (1): 37–49. PMID 5565077.
- ↑ Tadros, W; Lipshitz, HD (March 2005). "Setting the stage for development: mRNA translation and stability during oocyte maturation and egg activation in Drosophila". Developmental Dynamics. 232 (3): 593–608. PMID 15704150. डीओआइ:10.1002/dvdy.20297.
- ↑ अ आ Etkin LD (1988). "Regulation of the Mid-Blastula Transition in Amphibians". प्रकाशित Browder LW (संपा॰). The Molecular Biology of Cell Determination and Cell Differentiation. Developmental Biology. 5. New York. पपृ॰ 209–25. PMID 3077975. आई॰ऍस॰बी॰ऍन॰ 978-1-4615-6819-3. डीओआइ:10.1007/978-1-4615-6817-9_7.
- ↑ Tadros, W; Westwood, JT; Lipshitz, HD (June 2007). "The mother-to-child transition". Developmental Cell. 12 (6): 847–9. PMID 17543857. डीओआइ:10.1016/j.devcel.2007.05.009.
- ↑ Weigel, D; Izaurralde, E (24 March 2006). "A tiny helper lightens the maternal load". Cell. 124 (6): 1117–8. PMID 16564001. डीओआइ:10.1016/j.cell.2006.03.005.
- ↑ अ आ इ ई Fleming, Tom P.; Papenbrock, Tom; Fesenko, Irina; Hausen, Peter; Sheth, Bhavwanti (1 August 2000). "Assembly of tight junctions during early vertebrate development". Seminars in Cell & Developmental Biology. 11 (4): 291–299. PMID 10966863. डीओआइ:10.1006/scdb.2000.0179.
- ↑ Watson, J.G. (October 1977). "Collection and Transfer of Preimplantation Mouse Embryos". Biology of Reproduction. 17 (3): 453–8. PMID 901897. डीओआइ:10.1095/biolreprod17.3.453.
- ↑ Viczian, Andrea S.; Solessio, Eduardo C.; Lyou, Yung; Zuber, Michael E. (August 2009). "Generation of Functional Eyes from Pluripotent Cells". PLOS Biology. 7 (8): e1000174. PMID 19688031. डीओआइ:10.1371/journal.pbio.1000174. पी॰एम॰सी॰ 2716519.
ग्रन्थसूची
संपादित करें- Forgács, G.; Newman, Stuart A. (2005). "Cleavage and blastula formation". Biological physics of the developing embryo. Cambridge University Press. आई॰ऍस॰बी॰ऍन॰ 978-0-521-78337-8.
- Cullen, K.E. (2009). "embryology and early animal development". Encyclopedia of life science, Volume 2. Infobase. आई॰ऍस॰बी॰ऍन॰ 978-0-8160-7008-4.
- McGeady, Thomas A., संपा॰ (2006). "Gastrulation". Veterinary embryology. Wiley-Blackwell. आई॰ऍस॰बी॰ऍन॰ 978-1-4051-1147-8.